-
我国是历史悠久的文明古国。下列古代工艺不属于化学变化的是
A. 稻草造纸 B. 纺纱织布 C. 冶炼金属 D. 火药爆炸
难度: 简单查看答案及解析
-
糖醋鱼是百姓喜爱的家常菜。制作时用到的下列原料,富含蛋白质的是
A. 草鱼 B. 白糖 C. 淀粉 D. 植物油
难度: 简单查看答案及解析
-
俗话说“雷雨发庄稼”。雷雨天,氮气经一系列变化后,转化为农作物所需的肥料,该肥料属于
A. 钾肥 B. 磷肥 C. 复合肥 D. 氮肥
难度: 简单查看答案及解析
-
下列物质的用途中利用其物理性质的是
A. 天然气作燃料 B. 小苏打用于烘焙面包
C. 干冰实施人工增雨 D. 氮气用于粮食保护气
难度: 简单查看答案及解析
-
下列图示的实验操作中正确的是
A.
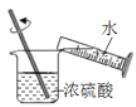 稀释浓硫酸
稀释浓硫酸B.
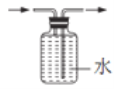 收集O2
收集O2C.
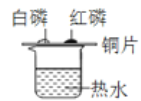 验证:可燃物燃烧需要与O2接触且温度达到着火点
验证:可燃物燃烧需要与O2接触且温度达到着火点D.
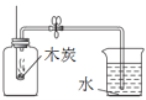 测定空气中O2的体积分数
测定空气中O2的体积分数难度: 简单查看答案及解析
-
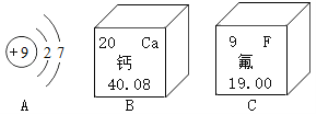
化学上把同种元素组成的不同单质互称为同素导形体,例如白磷和红磷,下列各组物质互为同素异形体的是( )
A.CO和CO2 B.金刚石和石墨 C.冰和干冰 D.液氧和氧气
难度: 简单查看答案及解析
-
复方冬青油软膏有强力镇痛作用。其有效成分的分子模型如图。下列说法中错误的是
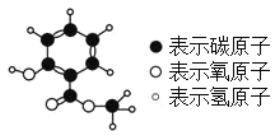
A. 该物质属于有机物
B. 该物质的化学式为C8H8O3
C. 该物质完全燃烧生成CO2和H2O
D. 该物质分子中氢、氧原子的质量比为8∶3
难度: 中等查看答案及解析
-
某反应的微观示意图如下,下列说法正确的是
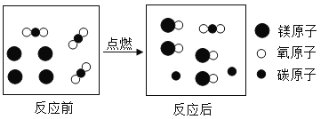
A. 图中反应的基本类型是置换反应
B. 反应前后元素的种类及化合价均不变
C. 反应涉及到的物质中,
属于单质,只有
属于氧化物
D. 参加反应的
和
的微粒个数比是4∶3
难度: 中等查看答案及解析
-
下列根据实验操作所得出的现象和结论均正确的是
选项
实验操作
实验现象
结论
A
打开盛有浓盐酸的瓶盖
瓶口出现白烟
浓盐酸具有挥发性
B
向紫色石蕊溶液中通入CO2气体
溶液变成红色
不能说明CO2与水反应
C
向盛有水的烧杯中加入活性炭
异味消失
活性炭与水发生化学反应
D
向H2O2溶液中加入少量CuO粉末
产生大量气泡
CuO是该反应的催化剂
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图甲、图乙所示。将图甲与图乙的阴影部分进行叠加,发现两者基本重合。下列有关分析错误的是
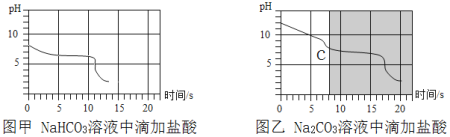
A. 图甲涉及反应的化学方程式为NaHCO3 + HCl = NaCl + H2O + CO2↑
B. 实验中所使用的NaHCO3溶液的碱性比Na2CO3溶液弱
C. 实验中碳酸氢钠、碳酸钠溶液完全反应,消耗的盐酸一样多
D. 图乙中c点对应溶液的溶质含有NaHCO3
难度: 中等查看答案及解析