-
下列有关电化学知识的描述正确的是( )
A. 行人踩踏发电瓷砖(原理是利用行人踩踏地板产生的振动来发电)是将化学能转化为电能
B. 某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥可以装有含琼胶的KCl饱和溶液
C. 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极、铜作正极
D. 理论上,任何能自发进行的且能放出能量的氧化还原反应都可设计成原电池
难度: 中等查看答案及解析
-
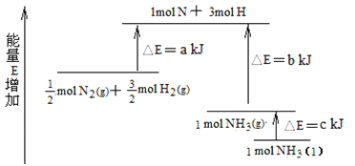
反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.
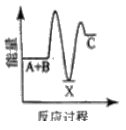 B.
B. 
C.
 D.
D. 
难度: 中等查看答案及解析
-
在四个不同的容器中,在不同条件下利用N2+3H2==2NH3反应来合成氨,根据下列在相同时间内测定的结果判断,生成氨的速率最大的是 ( )
A. v(H2)=0.1 mol·(L·min)−1 B. v(N2)=0.01 mol·(L·s)−1
C. v(N2)=0.2 mol·(L·min)−1 D. v(NH3)=0.3 mol·(L·min)−1
难度: 中等查看答案及解析
-
某同学做了如下实验:
装置
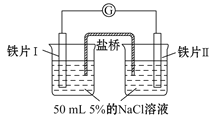
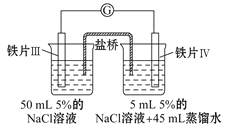
现象
电流计指针未发生偏转
电流计指针发生偏转
下列说法中正确的是
A.加热铁片Ⅰ所在烧杯,电流表指针会发生偏转
B.用KSCN溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极
C.铁片Ⅰ、Ⅲ的腐蚀速率相等
D.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀
难度: 困难查看答案及解析
-
氢卤酸的能量关系如图所示下列说法正确的是
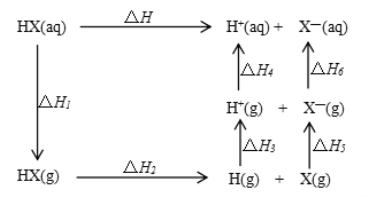
A.已知HF气体溶于水放热,则HF的△H1<0
B.相同条件下,HCl的△H2比HBr的小
C.相同条件下,HCl的△H3+△H4比HI的大
D.一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
难度: 中等查看答案及解析
-
下列能用勒夏特列原理解释的是( )
A.H2、I2、HI平衡混合气加压后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.SO2催化氧化成SO3的反应,往往需要使用催化剂
难度: 中等查看答案及解析
-
可逆反应3H2(g) + N2(g)
2NH3(g) △H〈0在一定条件下达到平衡状态,时间为t1时改变条件,化学反应速率与反应时间关系如图,下列说法中正确的是( )

A.维持温度,反应体系体积不变,t1时充入NH3(g)
B.维持温度、压强不变,t1时充入NH3
C.维持温度不变,t1时扩大反应体系体积
D.维持压强不变,t1时升高反应体系温度
难度: 中等查看答案及解析
-
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)
xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是 ( ).
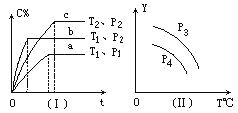
A. p3>p4,Y轴表示A的质量 B. p3<p4,Y轴表示B的百分含量
C. p3>p4,Y轴表示混合气体密度 D. p3>p4,Y轴表示混合气体平均摩尔质量
难度: 困难查看答案及解析
-
一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法不正确的是( )

A.这些离子中结合H+能力最强的是B
B.A,B,C,D,E五种微粒中A最稳定
C.C→B+D的反应,反应物的总键能大于生成物的总键能
D.B→A+D是放热反应
难度: 简单查看答案及解析
-
在容积为1 L的恒容密闭容器中充入CO(g)和H2O(g),发生反应:CO(g) + H2O(g)
CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
实验
编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(CO)
n(H2O)
n(CO2)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法正确的是
A. 实验①中,若5 min时测得n (CO2) =0.050 mol,则0至5 min时间内,用H2表示的平均反应速率υ (H2) = 5.0×10-2 mol/(L·min)
B. 实验②中,该条件下反应的平衡常数K =2.0
C. 实验③中,达到平衡时,CO的转化率为60%
D. 实验④中,达到平衡时,b>0.060
难度: 中等查看答案及解析
-
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
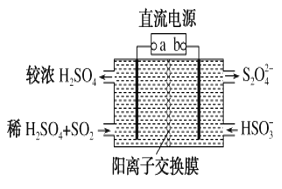
A. a为直流电源的负极
B. 阴极的电极反应式为2HSO3-+2H++e-=S2O42-+2H2O
C. 阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
D. 电解时,H+由阴极室通过阳离子交换膜到阳极室
难度: 中等查看答案及解析
-
向1L的密闭容器中加入1molX、0.3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间的变化如图甲所示。图乙为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是

A. Y的起始物质的量为0.5mol
B. 该反应的化学方程式为2X(g)+Y(g)
3Z(g) ΔH<0
C. 若t0 =0,t1=10s,则t0~t1阶段的平均反应速率为v(Z)=0.03mol·L-1·s-1
D. 反应物X的转化率t6点比t3点高
难度: 中等查看答案及解析
-
可逆反应A2 + 3B2(?)
2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是( )

A.该反应为吸热反应
B.反应物B2为气体
C.升高温度,逆反应速率减慢
D.增大压强,A2转化率减小
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率
B.恒温下进行的反应2NO2(g)
N2O4(g)达平衡时,缩小容器体积再达平衡时,气体的颜色比第一次平衡时的深,NO2的体积分数比原平衡大
C.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0
D.对于反应3KSCN(aq)+FeCl3(aq)
Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大
难度: 中等查看答案及解析
-
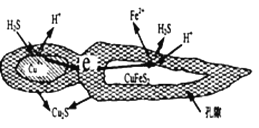
在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )

A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
难度: 困难查看答案及解析
-
已知在一定条件下2SO2(g)+O2(g)
2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2molSO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A. Q>Q1>Q2 B. Q2>Q>Q1 C. Q1>Q>Q2 D. Q>Q1=Q2
难度: 困难查看答案及解析
-
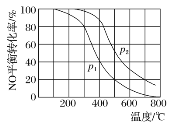
在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g)
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
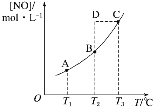
A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
难度: 困难查看答案及解析
-
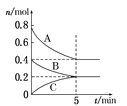
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
图Ⅰ
 图Ⅱ
图Ⅱ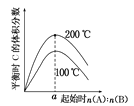
A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. 图Ⅱ所知反应xA(g)+yB(g)
zC(g)的ΔH>0,且a=2
C. 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v正>v逆
D. 200 ℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A的体积分数等于0.5
难度: 简单查看答案及解析