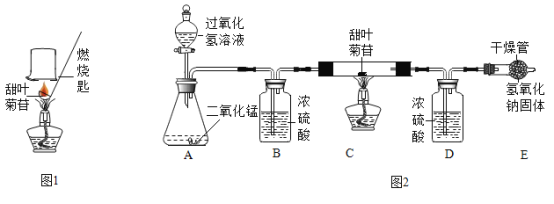
-
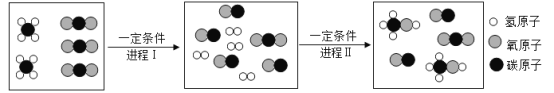
2016年诺贝尔化学奖得主为创造“分子机器”,一种可以执行类似机器 运动的独立分子或分子组做出了贡献。下列叙述中一定涉及化学变化的是
A.分子机器按指令运输特定的分子
B.分子机器将某些分子按照一定规律排列
C.分子机器运载分子需要消耗能量
D.分子机器将不同的分子组装成新的分子
难度: 简单查看答案及解析
-
如图所示,某同学给化学药品贴的标签,其中不正确的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
分类是研究物质的常用方法。如图是纯净物、单质、化合物、氧化物之间关系的形象表示,若整个大圆圈表示纯净物,则下列物质属于Z范围的是
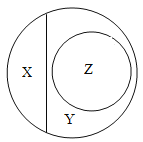
A.氦气 B.硫酸锌 C.过氧化氢 D.空气
难度: 简单查看答案及解析
-
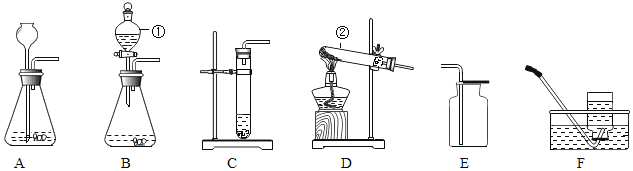
下列装置或操作肯定不能达到实验目的的是
A.
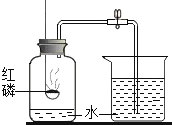 测定空气中氧气含量
测定空气中氧气含量B.
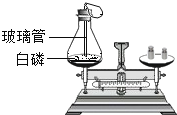 探究质量守恒定律
探究质量守恒定律C.
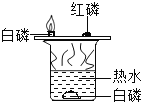 探究燃烧条件
探究燃烧条件D.
 验满氧气
验满氧气难度: 简单查看答案及解析
-
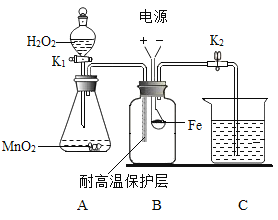
某同学发现,H2O2溶液中加入CuO粉末,分解速度明显加快。为确定CuO在该反应中作催化剂,至少需要实验或测定记录的项目有:①实验温度②H2O2 的浓度③CuO反应前后的质量④CuO 反应前后的形状⑤将 反应后过滤得到的CuO重新加人H2O2溶液中,观察反应速率。下列正确的是
A.③⑤
B.②④
C.①②③
D.①②③④⑤
难度: 简单查看答案及解析
-
对下列图示信息的分析错误的是
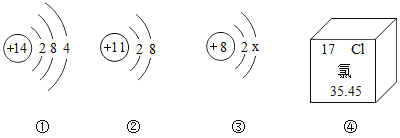
A.②对应的元素位于元素周期表第三周期
B.①是硅原子的结构示意图
C.若图③中x的值为8,则其粒子符号为O2-
D.图②④对应元素组成的化合物是由分子构成的
难度: 简单查看答案及解析
-
苯(C6H6)、六氯苯(C6Cl6)都是重要的化工原料,下列有关说法错误的是
A.C6H6由碳、氢两种元素组成
B.碳元素的质量分数:C6H6 >C6Cl6
C.C6Cl6由6个碳原子与6个氯原子构成
D.C6H6是由C6H6分子构成
难度: 简单查看答案及解析
-
用如图所示装置来测定空气中氧气的含量,对该实验认识错误的是
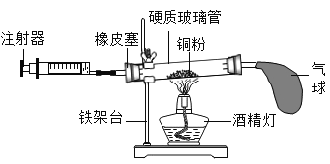
A.铜粉用量不足会导致测得结果偏低
B.实验结束后冷却到室温才能读数
C.气球的作用是调节气压,使氧气完全反应
D.在正常操作情况下,反应结束后消耗氧气的总体积应该是反应前注射器内气体体积的1/5
难度: 简单查看答案及解析
-
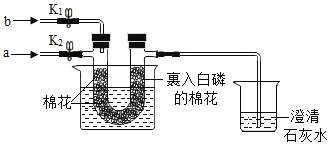
纳米铁粉在空气中能自燃并生成一种红色氧化物。对比铁丝在空气中不能燃烧,而在氧气中能剧烈燃烧的事实,某同学得出的下列结论错误的是
A.纳米铁粉在空气中自燃的产物不是四氧化三铁
B.有些物质燃烧时温度不需要达到着火点
C.相同的反应物在不同条件下生成物可能不同
D.反应物间的接触面积大小是反应能否发生的因素之一
难度: 中等查看答案及解析
-
在
反应中,32gA和适量的B恰好完全反应生成36g C和100gD。若A的化学式量为16,则下列说法错误的是
A.B的化学式量为26
B.参加反应B的质量为104g
C.D与C化学式量之比为25:6
D.若要生成25gD,需参加反应A的质量为18g
难度: 中等查看答案及解析
-
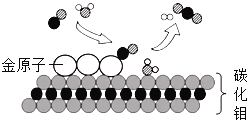
一种新型火箭推进剂在火箭发射过程中,发生反应的微观过程如下。下列说法错误的是
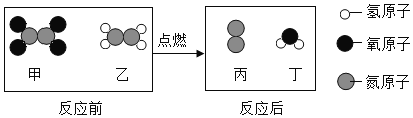
A.燃烧不一定有氧气参加
B.参加反应的甲与乙的分子个数比为1:1
C.生成丙与丁的质量之比为7:6
D.该反应中涉及两种氧化物
难度: 简单查看答案及解析
-
分析下列化学反应,所得结论不正确的是
①
;②
;③
。
A.碳、一氧化碳和氢气一样都具有可燃性
B.反应物相同,参加反应的物质的量不同时,生成物不同
C.上述反应都是化合反应,且生成物都是氧化物
D.③反应在有限空间内进行一定会发生爆炸
难度: 中等查看答案及解析
-
下列四个图像,分别对应四种操作,其中正确的是
A.
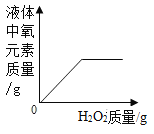 向盛有一定量MnO2的烧杯中加入H2O2溶液
向盛有一定量MnO2的烧杯中加入H2O2溶液B.
加热一定质量氯酸钾和二氧化锰的混合物
C.
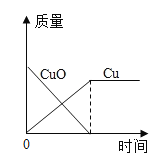 加热碳和氧化铜,恰好完全反应生成铜和二氧化碳
加热碳和氧化铜,恰好完全反应生成铜和二氧化碳D.
用红磷测定空气中氧气含量
难度: 中等查看答案及解析