-
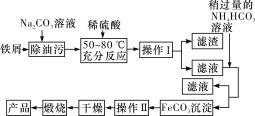
《开宝本草》中记载了中药材铁华粉的制作方法:“取钢煅作叶如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”中药材铁华粉是( )
A.氧化铁 B.氯化亚铁 C.氯化铁 D.醋酸亚铁
难度: 中等查看答案及解析
-
化学与生产生活、环境保护、资源利用等密切相关。下列说法正确的是( )
A.白酒的主要成分是乙醇,玉米中的淀粉经水解可变成乙醇
B.港珠澳大桥钢筋表面的环氧树脂涂层属于合成高分子材料
C.火箭推进剂使用的偏二甲肼-四氧化二氮在高空时对环境污染小
D.海洋中含有丰富的矿产资源,仅利用物理方法可以获得Br2和Mg
难度: 中等查看答案及解析
-
下列与有机物的结构、性质的有关叙述中正确的是( )
A.乙酸与乙醇可以发生酯化反应,又均可与金属钠发生反应
B.乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
C.分馏、干馏都是物理变化,裂化、裂解都是化学变化
D.石油经过分馏得到多种烃,煤经过分馏可制得焦炭、煤焦油等产品
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.中子数为18的氯原子:
B.次氯酸的电子式:
C.10g 46.0%的乙醇溶液中,含H-O键的数目为0.7NA
D.0.1NA的Cl2与CH4在光照下反应,生成2.24L的HCl
难度: 中等查看答案及解析
-
已知微粒还原性强弱顺序:I->Fe2+>Br-。向含有FeI2和FeBr2的溶液中通入一定量氯气后,经测所得溶液中有Fe2+、Cl-存在,则一定还存在的离子有( )
A.I- B.Br- C.Fe3+ D.Fe3+、I-
难度: 中等查看答案及解析
-
分子式为C4H7Br的链状有机物共有(不考虑立体异构)( )
A.4种 B.6种 C.8种 D.10种
难度: 中等查看答案及解析
-
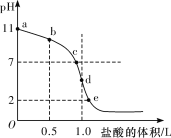
用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用蒸馏水洗净锥形瓶后,装入20.00mLNaOH溶液,加入少量的蒸馏水再进行滴定
D.用酚酞作指示剂滴至红色刚变无色时,立即停止加盐酸并读数
难度: 简单查看答案及解析
-
有关乙烯和苯的性质实验:①足量乙烯通入溴的CCl4溶液;②足量苯滴入溴的CCl4溶液。下列对上述实验现象的描述正确的是( )
A.①不褪色,②褪色 B.①褪色,②不褪色 C.①、②均褪色 D.①、②均不褪色
难度: 简单查看答案及解析
-
离子交换法净化水的过程如图所示。下列说法正确的是( )
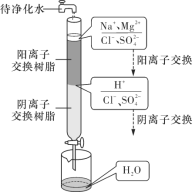
A.经过阳离子交换树脂后,水中阳离子总数减少
B.通过阴离子交换树脂后,水中只有SO42-被除去
C.通过净化处理后的水,导电性增强
D.阴离子交换树脂填充段存在反应H+ + OH-= H2O
难度: 中等查看答案及解析
-
M、N、R均为短周期主族元素,它们原子的最外层电子数之和为10,M与R同族,N最外层电子数等于M次外层电子数,且N原子半径大于R原子半径。下列叙述不正确的是( )
A.熔点:M的氧化物比N的氧化物高
B.热稳定性:M的氢化物大于R的氢化物
C.M与R形成的是共价化合物RM
D.N的单质能溶于浓硝酸,R的单质不溶于浓硝酸
难度: 困难查看答案及解析
-
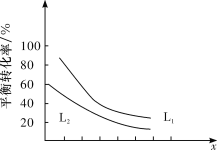
汽车尾气无害化处理时发生反应2NO(g) + 2CO(g)
N2(g)+2CO2(g),且降温反应物的转化率增大。下列说法正确的是( )
A.该反应△H>0
B.降低温度转化率增大,是因为正反应速率增大,逆反应速率减小
C.增大压强,可以使NO和CO完全转化为无污染的N2和CO2而消除污染
D.升高温度,该反应的平衡常数K将减小
难度: 中等查看答案及解析
-
已知下列反应的平衡常数:①H2(g)+S(s)
H2S(g),K1;②S(s)+O2(g)
SO2(g),K2;则反应H2(g)+SO2(g)
O2(g)+H2S(g)的平衡常数是
A. K1+K2 B. K1-K2 C. K1×K2 D. K1/K2
难度: 简单查看答案及解析
-
氢氧燃料电池可以在航天飞机上使用,其反应原理示意图如下。下列有关氢氧燃料电池的说法正确的是( )
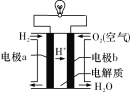
A.电池中电极a是正极
B.外电路中电子由电极a通过导线流向电极b
C.负极电极反应式:O2 + 4H ++ 4e- = 2H2O
D.燃料电池的能量转化率可达100%
难度: 简单查看答案及解析
-
下列反应在任何温度下均能自发进行的是
A.N2H4(l)+
N2O4(l)=
N2 (g)+2H2O(l) △H= -546.45 kJ▪mol-1
B.Mg2Ni(s)+2H2(g)= Mg2NiH4(s) △H= -64.4 kJ▪mol-1
C.CH4(g)+H2O(g)
CO(g)+3H2(g) △H= +206.4 kJ▪mol-1
D.2N2(g)+O2(g)= 2N2O(g) △H= +163 kJ▪mol-1
难度: 简单查看答案及解析
-
常温下,关于pH=12的NaOH溶液,下列说法正确的是( )
A.溶液中c(H+)=1.0×10-2 mol▪L-1
B.溶液中由水电离出的c(OH-)=1.0×10-2 mol▪L-1
C.加水稀释100倍后,溶液的pH=10
D.加入等体积pH=2的醋酸,溶液呈中性
难度: 中等查看答案及解析
-
某固体混合物中可能含有Na+、K+、SO42-、Cl-、CO32-等离子,取两份该固体溶解后的溶液进行如下所示的实验:
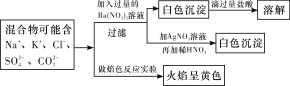
下列关于该混合物的组成说法正确的是( )
A.一定是K2CO3和NaCl B.可能是Na2CO3和KCl
C.可能是Na2SO4和Na2CO3 D.一定是Na2CO3和NaCl
难度: 困难查看答案及解析