-
2018年10月在《自然一催化》杂志上刊登了中科院院士李灿发表的有关高效单核催化剂的文章,为实现“液态阳光”构想迈出了关键一步。“液态阳光”是指由阳光、二氧化碳和水通过人工光合作用得到的绿色液态燃料。下列有关“液态阳光”的说法错误的是( )
A.煤气化得到的水煤气不属于“液态阳光”
B.“液态阳光”的主要成分可能为甲醇、乙醇和氨基酸
C.“液态阳光”行动有利于可持续发展和应对气候的变化
D.“液态阳光”有望解决全球化石燃料面临枯竭的难题
难度: 简单查看答案及解析
-
下列分别是利用不同能源发电的实例,其中不属于新能源开发利用的是( )
A.
 风力发电 B.
风力发电 B. 太阳能发电
太阳能发电C.
 火力发电 D.
火力发电 D. 潮汐能发电
潮汐能发电难度: 简单查看答案及解析
-
目前已进入“垃圾分类时代”。垃圾分类能最大限度地实现资源回收利用,改善生存环境状态。按垃圾的不同成分、属性、利用价值、对环境的影响以及不同处理方式的要求,对垃圾进行源头分类投放。废荧光灯管,废灯泡应放入下列哪个垃圾标识的垃圾桶中( )
A
B
C
D




可回收物
厨余垃圾
有害垃圾
其它垃圾
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
10mL某气态烃,在55mL氧气里完全燃烧,得到液态水和体积为35mL的混合气体(所有气体体积都是同温同压下测定的),则该气态烃可能是( )
A.甲烷 B.乙烷 C.丙烷 D.丁烷
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法不正确的是()
A.100mL 1mol/L CH3COOH溶液与足量的Na反应,生成H2分子数目为0.05NA
B.常温常压下,7g C2H4和C3H6的混合物中含有的氢原子数目为NA
C.1mol碳正离子
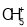 所含的电子数为10NA
所含的电子数为10NAD.0.1mol C10H22分子中共价键数目为3.1NA
难度: 简单查看答案及解析
-
下列有关操作正确的是( )
A.可以用水鉴别1,2-二溴乙烷、乙酸、四氯化碳三种有机物
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,可以实现乙醇被氧化为乙醛
C.FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯
D.使用AgNO3溶液验证三氯甲烷中是否含有氯元素,现象是产生白色沉淀
难度: 简单查看答案及解析
-
下列化学用语表示正确的是( )
①苯的分子式:
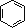
②
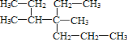 系统命名为3,4-二甲基-4-乙基庚烷
系统命名为3,4-二甲基-4-乙基庚烷③溴乙烷的电子式
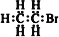
④乙烯的比例模型:

⑤1H+、2H2、2H、3H互为同位素
⑥葡萄糖的结构式:
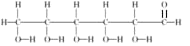
⑦
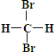 和
和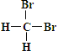 互为同分异构体
互为同分异构体⑧硝基苯的结构简式:
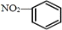
⑨乙酸的球棍模型:
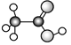
⑩同素异形体:C60、金刚石、石墨
A.②④⑤⑥ B.②③④⑤⑥ C.②④⑥⑨⑩ D.②⑥⑦⑧⑨⑩
难度: 中等查看答案及解析
-
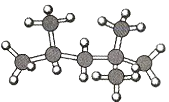
如图是某种有机物分子的模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种短周期元素的原子。下列对该有机物的叙述错误的是( )
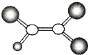
A.该有机物分子中可能含有碳碳双键
B.该有机物的分子式可能为C2HCl3
C.该有机物可以由乙烯和氯气加成反应得到
D.该有机物分子中的所有原子可能共平面
难度: 中等查看答案及解析
-
有机化工生产中可以通过由石油得到的乙烯和由煤得到的苯制聚苯乙烯,生产过程如下:
①CH2=CH2+
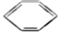 →
→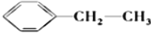
②
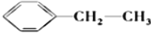
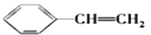
③
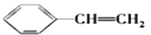 →
→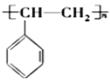
下列说法不正确的是( )
A.乙苯、苯乙烯的一氯代物均有5种
B.通过石油裂解可以获得更多的乙烯
C.1mol苯乙烯在一定条件下能与4molH2发生加成反应
D.反应①②③的原子利用率都达到了100%
难度: 中等查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷(
 )是其中的一种。下列关于该化合物的说法正确的是
)是其中的一种。下列关于该化合物的说法正确的是A.与甲苯(C7H8)互为同分异构体
B.1mol该化合物完全燃烧时消耗10 mol O2
C.所有碳原子均处同一平面
D.一氯代物共有3种(不含立体异构)
难度: 中等查看答案及解析
-
糖类、油脂和蛋白质是动物性和植物性食物中的基本营养物质。以下叙述正确的是( )
①油脂均不能使溴的四氯化碳溶液褪色
②汽油、柴油和植物油都是碳氢化合物
③糖类、油脂和蛋白质都能发生水解反应
④制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
⑤蔗糖溶液中加入稀硫酸,加热4~5min,再加入少量银氨溶液,水浴加热,有光亮银镜生成
⑥可用碘水检验淀粉是否水解完全
⑦皮肤上不慎沾上浓硝酸会出现黄色
⑧利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
⑨淀粉、棉花、羊毛、蚕丝、油脂都属于高分子化合物。
A.②③⑤⑦ B.①③④⑥⑧ C.①④⑤⑧⑨ D.④⑥⑦⑧
难度: 简单查看答案及解析
-
实验室制备、纯化硝基苯需要用到下列装置,其中不正确的是( )
A
B
C
D
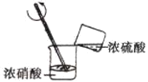
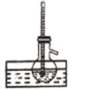
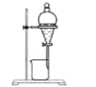
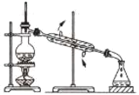
配制混酸
制备硝基苯
分离粗产品
精制产品
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如图:
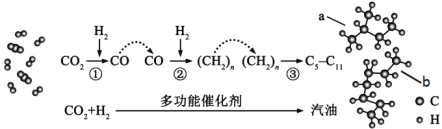
下列说法不正确的是( )
A.反应①的产物中含有水
B.反应②中只有碳碳键形成
C.图中b物质其主链上有5个碳原子的同分异构体有5种
D.汽油主要是C5C11的烃类混合物
难度: 中等查看答案及解析
-
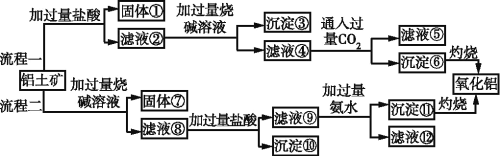
从海水中提取粗盐和溴的过程如图所示,下列有关说法错误的是( )
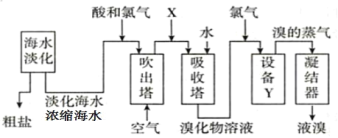
A.淡化海水的方法有蒸馏法、电渗析法、离子交换法等
B.X为SO2气体,也可换成Na2SO3
C.设备Y为蒸馏塔,在实验室可以用蒸馏装置代替
D.提取溴的过程中包含1次溴元素的氧化反应和1次溴元素的还原反应
难度: 中等查看答案及解析
-
某化学实验室产生的废液中含有 Fe3+、Cu2+、Ag+三种金属离子,甲同学设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。据此分析,下列说法正确的是( )
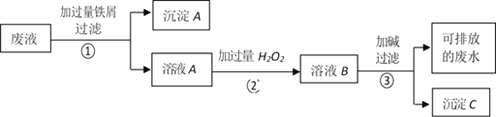
A.沉淀A中含有2种金属单质
B.可用 KSCN 溶液来检验溶液B中所含的金属离子
C.溶液 A 若只经过操作③最终将无法得到沉淀C
D.操作①②③中都需要用到玻璃棒、漏斗
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是( )
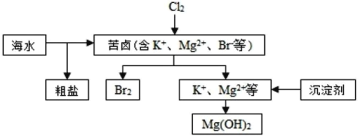
A.粗盐中的可溶性杂质可以通过化学反应生成沉淀而除去
B.向苦卤中通入Cl2是为了提取溴
C.工业生产中常选用NaOH作为沉淀剂
D.利用向海水晒盐后的苦卤水中加入沉淀剂的方法可实现对镁离子的提纯和富集
难度: 中等查看答案及解析
-
含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )
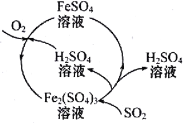
A.该过程中化合价发生改变的元素只有Fe和S
B.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
C.该工艺流程可以除去煤燃烧时产生的SO2
D.该过程中可得到化工产品H2SO4
难度: 中等查看答案及解析
-
实验室常用图1装置完成石蜡油的分解实验,用图2完成煤的干馏实验。下列说法不正确的是( )
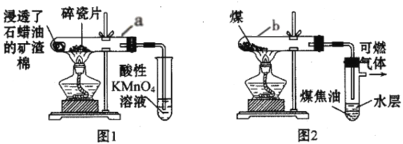
A.图1中石蜡油是液态烷烃混合物
B.上述两实验中分解生成的气体成分不同,但均含有不饱和烃
C.充分反应后,图2试管b中无固体物质残留
D.取图2中水层,加入浓NaOH溶液,加热可产生使湿润红色石蕊试纸变蓝的气体
难度: 中等查看答案及解析
-
化学与生活,生产密切相关,根据所学化学知识及常识,下列说法正确有几个( )
①重金属盐能使蛋白质变性,所以误食重金属盐会中毒
②煤的干馏和石油的催化重整均可获得芳香烃
③包装用材料聚乙烯和聚氯乙烯都属于烃
④氢能具有燃烧热值高,资源丰富等优点,目前氢已用作火箭和燃料电池的燃料
⑤煤经过气化和液化等物理变化可以转化为清洁能源
⑥推广乙醇汽油可以减轻环境污染,降低尾气中一氧化碳含量
⑦溴被称为海洋元素,地球上99%的溴元素以溴离子形式存在于海水中
⑧绿色化学的核心是利用化学原理对工业生产造成的环境污染进行治理
A.4 B.5 C.6 D.7
难度: 中等查看答案及解析
-
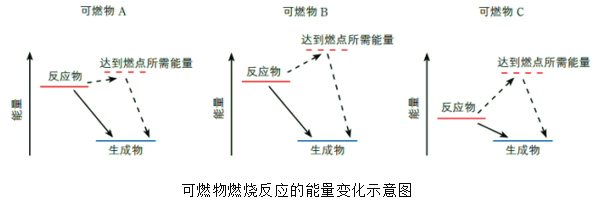
下列变化过程,属于放热反应的是( )
①水蒸气变成液态水
②Al粉和四氧化铁在高温下的反应
③生石灰溶于水
④炭和二氧化碳高温反应生成一氧化碳
⑤八水合氢氧化钡与氯化铵的反应
⑥硝酸铵溶于水
⑦盐酸与碳酸氢钠反应
A.①②③ B.①②④⑦ C.③④⑤⑥ D.②③
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
B.由C(s,石墨)═C(s,金刚石)△H=+1.9kJ•mol-1可知金刚石比石墨稳定
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知Ⅰ.反应H2(g)+Cl2(g)=2HCl(g)△H=-akJ·mol-1;Ⅱ.
 。且a、b、c均大于零,则断开1mol H-Cl键所需的能量为
。且a、b、c均大于零,则断开1mol H-Cl键所需的能量为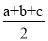 kJ
kJ难度: 中等查看答案及解析
-
根据下列信息判断氢气燃烧生成水时的热量变化,下列叙述一定正确的是( )
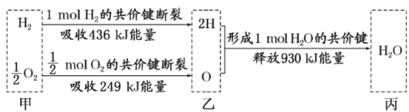
A.H原子比H2分子要稳定
B.氢气和氧气的总能量小于水的能量
C.生成1molH2O时吸收热量245kJ
D.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
难度: 中等查看答案及解析
-
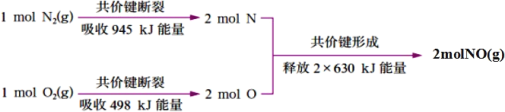
化学反应
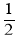 N2+
N2+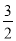 H2=NH3的能量变化如图所示,下列说法正确的是( )
H2=NH3的能量变化如图所示,下列说法正确的是( )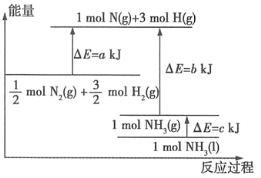
A.
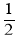 N2g+
N2g+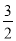 H2g=NH3l HabckJmol-1
H2g=NH3l HabckJmol-1B.断裂1mol N≡N键和3mol H-H键,吸收akJ热量
C.1mol NH3(l)的能量高于1molNH3(g)的能量
D.1mol N2(g)与3molH2(g)形成1mol NH3(l),放出bkJ热量
难度: 中等查看答案及解析
-
工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是( )
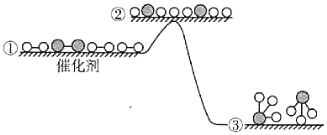
A.合成氨的正、逆反应的焓变相同
B.若使用催化剂,生成等量的NH3需要的时间更短
C.在该过程中,N原子和H原子形成了含有非极性键的氨气分子
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
难度: 中等查看答案及解析
-
下列有关反应热的叙述正确的有几个( )
①Ss
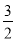 O2g=SO3g △H315kJmol-1(燃烧热)(△H的数值正确)
O2g=SO3g △H315kJmol-1(燃烧热)(△H的数值正确)②同一化学反应化学计量数不同,△H值不同。化学计量数相同而状态不同,△H值也不同
③H2的燃烧热是285.8kJ/mol,则2H2O(g)=2H2(g)+O2(g)反应的反应热△H=+571.6kJ/mol
④4P(g)+5O2(g)=2P2O5(g)△H1;4P(s)+5O2(g)=2P2O5(g)△H2,两个反应热关系为△H1<△H2
⑤两份等质量的氢气在氧气中充分燃烧,分别生成H2O(g)和H2O(l),前者放出热量多
⑥若2C(s)+O2(g)=2CO(g) △H=-221.0kJ·mol-1,则碳的燃烧热为110.5kJ·mol-1
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
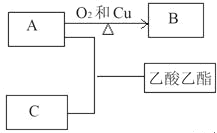
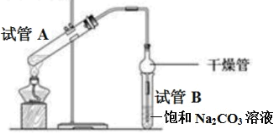
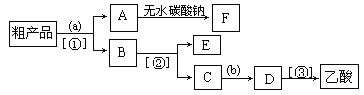
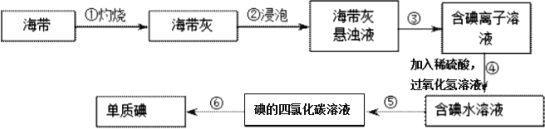
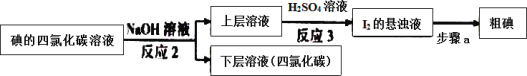
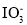 存在。写出上述流程中反应3获得I2的离子方程式______;流程中步骤a实验操作的名称是______。
存在。写出上述流程中反应3获得I2的离子方程式______;流程中步骤a实验操作的名称是______。