-
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 简单查看答案及解析
-
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为:①v(A)=0.45mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.4mol/(L·s) ④v(D)=0.45mol/(L·s)。下列有关反应速率的比较中正确的是( )
A.④>③=②>① B.①>④>②=③
C.①>②>③>④ D.④>③>②>①
难度: 简单查看答案及解析
-
某反应:A=B+C在室温下能自发进行,但在高温下不能自发进行,对该反应过程△H、△S的判断正确的是()
A.△H<0、△S<0 B.△H>0、△S<0 C.△H<0、△S>0 D.△H>0、△S>0
难度: 中等查看答案及解析
-
研究化学反应进行的方向对于反应设计等具有重要意义,下列说法正确的是
A.△H <0、△S >0的反应在温度低时不能自发进行
B.在其他外界条件不变的情况下,汽车排气管中使用催化剂,可以改变产生尾气的反应方向
C.反应 CaCO3(s) = CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H <0
D.一定温度下,反应 MgCl2(l) =Mg(l)+Cl2(g)的 △H >0、△S >0
难度: 简单查看答案及解析
-
X(s)+3Y(g)
 Z(g) ΔH=-a kJ·molˉ1,一定条件下,将2molX和2molY通入2L的恒容密闭容器中,反应10s,测得生成0.5molZ。下列说法正确的是
Z(g) ΔH=-a kJ·molˉ1,一定条件下,将2molX和2molY通入2L的恒容密闭容器中,反应10s,测得生成0.5molZ。下列说法正确的是A.10s内,X的平均反应速率为0.025mol·Lˉ1·sˉ1
B.第10s时,Y的反应速率为0.075mol·Lˉ1·sˉ1
C.第10s时,X为 1.5mol,Y的浓度为0.25mol·Lˉ1
D.10s内,X和Y反应放出的热量为akJ
难度: 中等查看答案及解析
-
在一恒温、恒容的密闭容器中存在化学平衡:H2(g)+I2(g)
 2HI(g),已知H2和I2的起始浓度均为0.10 mol·L-1,达到平衡状态时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度为
2HI(g),已知H2和I2的起始浓度均为0.10 mol·L-1,达到平衡状态时HI的浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.20 mol·L-1,则平衡时H2的浓度为A.0.16 mol·L-1 B.0.08 mol·L-1 C.0.04 mol·L-1 D.0.02 mol·L-1
难度: 中等查看答案及解析
-
下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
难度: 中等查看答案及解析
-
①10℃时10 mL 0.1 mol·L-1的Na2S2O3溶液和50 mL0.05 mol·L-1的H2SO4溶液;
②10℃时10 mL 0.05 mol·L-1的Na2S2O3溶液和10 mL 0.1 mol·L-1的H2SO4溶液;
③30℃时10 mL 0.05 mol·L-1的Na2S2O3溶液和10 mL 0.1 mol·L-1的H2SO4溶液。
若同时将它们混合发生反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,则出现浑浊的先后顺序是
A.①②③ B.②①③ C.③②① D.①③②
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,通入H2O(g)
D.保持压强不变,充入N2使容器体积增大
难度: 中等查看答案及解析
-
一定条件下,在体积为1L的密闭容器中,l molX和1 mol Y进行反应:2X(g)+Y(g)
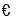 Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )。
Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )。A.c(X)∶c(Y)∶c(Z) = 2∶1∶l B.容器内原子总数不再发生变化
C.X的百分含量不再发生变化 D.同一时间内消耗2n mol X的同时生成n mol Z
难度: 中等查看答案及解析
-
在恒温恒容下使NH2COONH4 (s)
 2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )A.V正(NH3) =2V逆(CO2)
B.密闭容器中氨气的体积分数不变
C.密闭容器中总压强不变
D.密闭容器中混合气体的密度不变
难度: 中等查看答案及解析
-
对已经达到化学平衡的下列反应2X(g)+Y(g)⇌2Z(g) 减小压强时,对反应产生的影响是( )
A.正逆反应速率都增大,平衡向正反应方向移动
B.正逆反应速率都减小,平衡向逆反应方向移动
C.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
难度: 简单查看答案及解析
-
在一恒容密闭容器中,反应:A(g)+B(g)
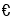 C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )
C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )A.A的浓度一定比原平衡小
B.A的转化率增大
C.C的体积分数一定大于原平衡C的体积分数
D.B的转化率一定增大
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)⇌zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L.下列有关判断正确的是( )
A.C的体积分数增大了 B.平衡向正反应方向移动
C.A的转化率降低了 D.x+y<z
难度: 中等查看答案及解析
-
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇,
(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
 CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )
CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )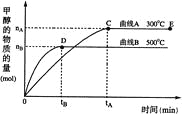
A.反应达到平衡时,平衡常数表达式 K=c(CH3OH)/c(CO)·c2(H2)
B.升高温度,K值增大
C.在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=3tB/2nBmol·(L·min)-1
D.其他条件不变,E点的体积压缩到原来的1/2,重新平衡时n(H2)/n(CH3OH)增大
难度: 简单查看答案及解析
-
对于反应aA(g)+bB(g)
 cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )
cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )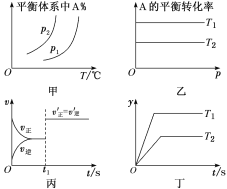
A.图甲中,若p1>p2,则在较低温度下有利于该反应自发进行
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
难度: 中等查看答案及解析
-
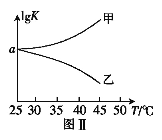
已知反应①CO(g)+CuO(s)
 CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )A.反应①的平衡常数K1=c(CO2).c(Cu)/[c(CO).c(CuO)]
B.反应③的平衡常数K=K1/K2
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
难度: 中等查看答案及解析
-
乙醇是重要的有机化工原料,可由乙烯水合法生产,反应的化学方程式如下:C2H4(g)+ H2O(g)
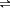 C2H5OH(g),下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4)∶n(H2O) =1∶1]。下列有关叙述正确的是
C2H5OH(g),下图为乙烯的平衡转化率与温度(T)、压强(P)的关系[起始n(C2H4)∶n(H2O) =1∶1]。下列有关叙述正确的是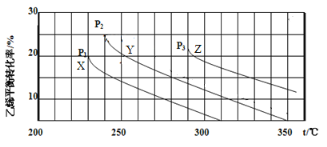
A. Y对应的乙醇的质量分数为1/9
B. X、Y、Z对应的反应速率:υ(X) > υ(Y) > υ(Z)
C. X、Y、Z对应的平衡常数数值:KX > KY > KZ
D. 增大压强、升高温度均可提高乙烯的平衡转化率
难度: 中等查看答案及解析
-
对于气相反应,用某组分(B)的平衡压强[p(B)]代替物质的量浓度(cB)也可表示平衡常数(记作Kp)。已知反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g),在t℃时的平衡常数 Kp=a,则下列说法正确的是
A.Kp=
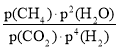
B.升高温度,若Kp 增大,则该反应为吸热反应
C.该反应达到平衡状态后,增大压强,平衡向左移动,Kp减小
D.t℃时,反应
 CH4(g)+H2O(g)⇌
CH4(g)+H2O(g)⇌ CO2(g)+2H2 (g)的平衡常数Kp=
CO2(g)+2H2 (g)的平衡常数Kp= a
a难度: 简单查看答案及解析
-
某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g)
 C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
A. a=2
B. 达到平衡时A的转化率为60%
C. 速率随时间变化关系如图所示
D. 为提高A的转化率,可采取升高温度的措施
难度: 中等查看答案及解析
-
已知反应 CO(g)+H2O(g)⇌CO2(g)+H2(g) △H = -43kJ·mol-1,在850℃时K=1。今在某密闭容器中充入1.0molCO、3.0molH2O、1.0molCO2和x molH2,下列说法不正确的是
A.900℃ 时,该反应的平衡常数 K<1
B.850℃ 时,若x=5.0,则起始时反应向逆反应方向进行
C.850℃达到化学平衡后,通入CO,化学平衡逆向移动
D.850℃时,若要使上述反应开始时向正反应方向进行,则x 应满足x<3.0
难度: 中等查看答案及解析
-
下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应
平衡常数
温度
973K
1173K
① Fe(s) + CO2(g)
 FeO(s) + CO(g) ΔH 1
FeO(s) + CO(g) ΔH 1K1
1.47
2.15
② Fe(s) + H2O(g)
 FeO(s) + H2(g) ΔH 2
FeO(s) + H2(g) ΔH 2K2
2.38
1.67
③ CO(g) + H2O(g)
 CO2(g) + H2(g) ΔH 3
CO2(g) + H2(g) ΔH 3K3
?
?
则下列说法正确的是
A.ΔH 1<0,ΔH 2>0
B.反应①②③的反应热满足关系:ΔH 2-ΔH 1=ΔH 3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
难度: 简单查看答案及解析
-
在容积一定的密闭容器中,置入一定量的 NO(g)和足量C(s),发生反应 C(s)+2NO(g)
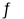 CO2(g)+N2(g),平衡状态时 NO(g)的物质的量浓度 c(NO)与温度 T 的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时 NO(g)的物质的量浓度 c(NO)与温度 T 的关系如图所示。则下列说法中正确的是( )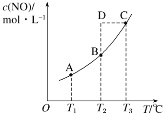
A.该反应的 ΔH>0 B.若该反应在 T1、T2 时的平衡常数分别为 K1、K2,则 K1<K2
C.在 T3 时,若混合气体的密度不再变化,则可以判断反应达到平衡状态 C D.在 T2 时,若反应体系处于状态D,则此时一定有 v 正<v 逆
难度: 中等查看答案及解析
-
温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)
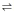 PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:t/s
0
50
150
250
250
n(PCl3)/mol
0
0.16
0.19
0.20
0.20
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
难度: 中等查看答案及解析
-
80℃时,NO2(g)+SO2(g)
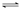 SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )起始浓度
甲
乙
丙
c(NO2)/mol ·L-1
0.10
0.20
0.20
c(SO2)/mol ·L-1
0.10
0.10
0.20
A.平衡时,乙中SO2的转化率大于50%
B.当反应平衡时,丙中c(SO2)是甲中的2倍
C.温度升至90℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol ·L-1 NO2和0.20 mol ·L-1 SO2,达到平衡时c(NO)与原平衡不同
难度: 困难查看答案及解析
 N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2 CO2(g)。一定温度下, 在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
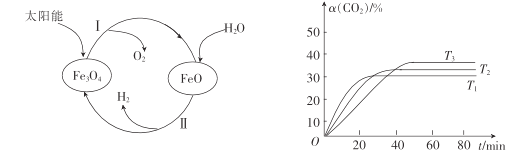
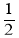 O2(g)△H1+285.5kJ·mol-1
O2(g)△H1+285.5kJ·mol-1 B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表: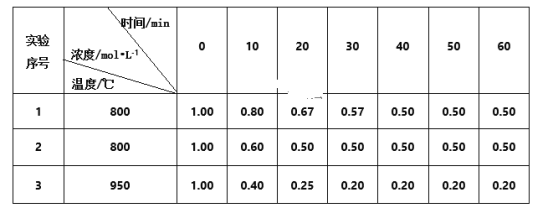
 NaNO3(s)+NOCl(g) ΔH1=a kJ∙mol-1
NaNO3(s)+NOCl(g) ΔH1=a kJ∙mol-1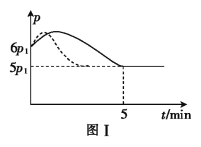
 CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。