-
下面的价电子排布中,第一电离能最小的原子可能是( )
A.ns2np3 B.ns2np5 C.ns2np4 D.ns2np6
难度: 中等查看答案及解析
-
国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是( )
A.75%的乙醇指的是体积分数 B.NaClO与洁厕灵混用消毒效果更好
C.过氧乙酸通过氧化性灭活病毒 D.氯仿的分子式为CHCl3是一种良好的有机溶剂
难度: 简单查看答案及解析
-
下列反应式中,不能正确表达反应颜色变化的是( )
A.过氧化钠在空气中放置后由淡黄色变为白色:2Na2O2 === 2Na2O + O2↑
B.用稀硫酸酸化的淀粉KI溶液在空气中放置会变蓝:4I- + O2 + 4H+ === 2I2 + 2H2O
C.浓硫酸滴到蔗糖中,蔗糖变黑,体现浓硫酸脱水性:C12H22O11
 12C + 11H2O
12C + 11H2OD.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2 + 2FeCl3 === 2Fe(OH)3 + 3MgCl2
难度: 中等查看答案及解析
-
下列关于C、Si及其化合物结构与性质的论述错误的是( )
A.键能C-C>Si- Si、C-H>Si-H,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-p π键
D.SiH4中 Si的化合价为+4,CH4 中C的化合价为-4,因此SiH4还原性小于CH4
难度: 简单查看答案及解析
-
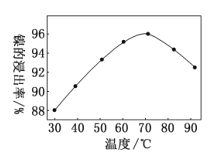
某白色固体混合物由NaCl、KCl、 MgSO4、 CaCO3 中的一种或 者几种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,火焰颜色为黄色;③向溶液中加碱,产生白色沉淀。根据实验现象对其组成判断正确的是( )
A.可能为KCl、NaCl B.一定为NaCl、 MgSO4
C.可能为NaCl、KCl、MgSO4 D.可能为KCl 、MgSO4、 CaCO3
难度: 简单查看答案及解析
-
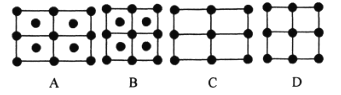
下列选用的仪器和药品不能达到实验目的的是( )
A
B
C
D
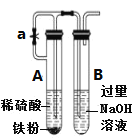
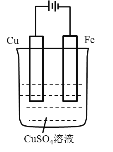

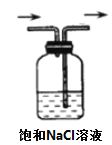
制备Fe(OH)2并能较长时间看到白色沉淀
在铁上镀铜
制备无水MgCl2
除Cl2中的HCl
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X、Y、Z、M、Q五种短周期元素,原子序数依次增大。M是地壳中含量第二高的元素,Y元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法不正确的是( )
A.Y、Z、M形成简单氢化物稳定性:Z>Y>M
B.X、Y、Z、M的原子半径:M>Z>Y>X
C.Z2X4的水溶液呈碱性
D.ZQ3中原子最外层都满足8电子稳定结构
难度: 中等查看答案及解析
-
从中草药中提取的calebin A (结构简式如下)可用于治疗阿尔茨海默症。下列关于calebin A说法错误的是( )
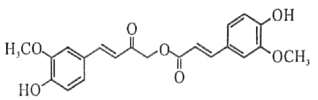
A.苯环上氢原子发生氯代时,一氯代物有6种
B.1 mol该物质与溴水反应,最多消耗5 mol Br2
C.其酸性水解的产物均可与Na2CO3溶液反应
D.l mol该分子最多与9 mol H2发生加成反应
难度: 中等查看答案及解析
-
熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为:2Na + x S
 Na2Sx (x = 5~3,难溶 于熔融硫)。下列说法错误的是( )
Na2Sx (x = 5~3,难溶 于熔融硫)。下列说法错误的是( )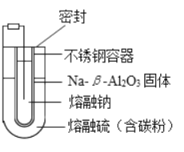
A.Na2S4的电子式为:

B.放电时正极反应为:xS + 2Na+ + 2e- === Na2Sx
C.充电时的阴极反应:Na - e- === Na+
D.Na和S分别为电池的负极和正极
难度: 中等查看答案及解析
-
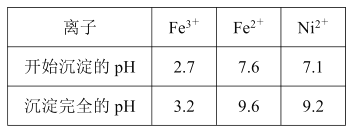
5 mL 0.1 mol/L KI溶液与1 mL 0.1mol/L FeCl3溶液发生反应:2Fe3+ (aq) + 2I- (aq) = 2Fe2+ (aq) + I2(aq),达到平衡。 下列说法不正确的是( )
A.加入苯,振荡,平衡正向移动
B.加入FeSO4固体,平衡逆向移动
C.该反应的平衡常数K=
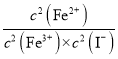
D.经苯2次萃取分离后,在水溶液中加入KSCN溶液,溶液呈红色,表明该化学反应存在限度
难度: 简单查看答案及解析
-
交联聚合物P的结构片段如图所示。下列说法不正确的是(图中
 表示链延长)
表示链延长)
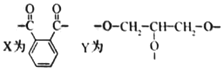
A.聚合物P中有酯基,能水解 B.聚合物P的合成反应为缩聚反应
C.邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构 D.聚合物P的原料之一丙三醇可由油脂水解获得
难度: 中等查看答案及解析
-
室温下,将两种浓度均为0.l mol/L的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系错误的是 ( )
A.NaHCO3-Na2CO3 混合溶液:c(Na+)>c(HCO
 )>c(CO
)>c(CO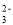 )>c(OH-)
)>c(OH-)B.氨水-NH4Cl 混合溶液(pH=9.25):c(NH3·H2O)>c(NH
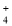 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)C.CH3COOH-CH3COONa 混合溶液:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+)
D.H2C2O4-NaHC2O4 混合溶液:2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O
 )
)难度: 中等查看答案及解析
 [CoC14]2- + 6H2O ΔH
[CoC14]2- + 6H2O ΔH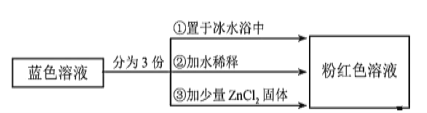
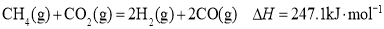
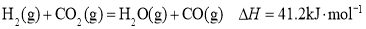
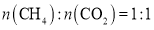 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是


 +B3O
+B3O +9H2↑
+9H2↑ 。在该反应中,B原子的杂化轨道类型由_____变为______。
。在该反应中,B原子的杂化轨道类型由_____变为______。
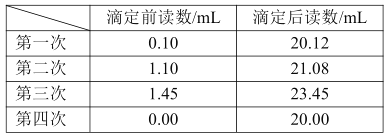
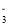 、SO
、SO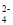 ,研究小组欲测定其中HSO
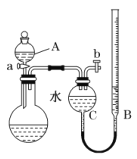
,研究小组欲测定其中HSO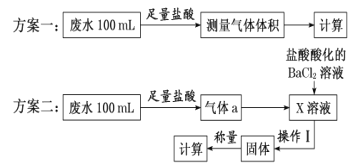



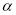 -碳原子上的氢比较活泼,使酯与酯之间能发生缩合反应。
-碳原子上的氢比较活泼,使酯与酯之间能发生缩合反应。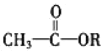 +
+ 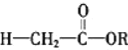

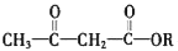 + ROH
+ ROH _________ (无机试剂任选)。
_________ (无机试剂任选)。