-
Fe3+、SO42-、Al3+和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,X可能是( )
A.Na+
B.OH-
C.CO32-
D.Cl-难度: 中等查看答案及解析
-
铝属于下列的( )
①重金属 ②轻金属 ③常见金属 ④稀有金属 ⑤黑色金属 ⑥有色金属.
A.①②⑤
B.②④⑥
C.②③⑥
D.②④⑤难度: 中等查看答案及解析
-
下列属于有机物的是( )
A.CO(NH2)2
B.(NH4)2CO3
C.CO
D.H2CO3难度: 中等查看答案及解析
-
下列物质中,属于烃类的是( )
A.C2H5OH
B.CH3Cl
C.C9H8
D.C6H5NO2难度: 中等查看答案及解析
-
下列氢化物中,稳定性最差的是( )
A.NH3
B.PH3
C.HF
D.H2O难度: 中等查看答案及解析
-
人体正常的血红蛋白中应含Fe2+.若误食亚硝酸钠,则导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒.服用维生素C可解除亚硝酸钠中毒.下列叙述中正确的是( )
A.亚硝酸钠表现了还原性
B.维生素C表现了还原性
C.维生素C将Fe3+氧化成Fe2+
D.亚硝酸钠被氧化难度: 中等查看答案及解析
-
10mL某气态烃与50mL氧气在密闭容器中点燃恰好完全反应,测得同条件下生成20mL CO2、20mL CO、40mL的水蒸气,则该烃的分子式为( )
A.C2H4
B.C3H8
C.C4H8
D.C4H10难度: 中等查看答案及解析
-
炼铁高炉中加入石灰石的目的是( )
A.作氧化剂
B.作熔剂造渣
C.作还原剂
D.作为合金成分形成铁合金难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是( )
A.氯化亚铁溶液中通入氯气:Fe2++Cl2→Fe3++2Cl-
B.氢氧化铁与硫酸:Fe(OH)3+3H+→Fe3++3H2O
C.氯化铁溶液和氢氧化钠:Fe3++3OH-→Fe(OH)3↓
D.四氧化三铁和盐酸:Fe3O4+8H+→2Fe3++Fe2++4H2O难度: 中等查看答案及解析
-
元素A的质子数为m,A2-和B3+的电子层结构相同,则B的核电荷数是( )
A.m+1
B.m+3
C.m+5
D.m-5难度: 中等查看答案及解析
-
在1.013×105Pa下,测得某些烷烃的沸点如下表.经分析下列选项正确的是( )
物 质 名 称 沸点(℃) 正丁烷CH3(CH2)2CH3 -0.5 正戊烷CH3(CH2)3CH3 36.0 异戊烷CH3CH2CHCH3
|
CH327.8 CH3
|
新戊烷CH3-C-CH3
|
CH39.5 正己烷CH3(CH2)4CH3 69.0
A.在标准状况下,新戊烷是气体
B.在1.013×105Pa,20℃时,C5H12都是液体
C.烷烃随碳原子数增加,沸点降低
D.C5H12随支链增加,沸点降低难度: 中等查看答案及解析
-
在加入铝粉能产生氢气的溶液中,下列各组离子可能大量共存的是( )
A.Fe2+、K+、NO3-、Cl-
B.Na+、Ba2+、Cl-、NO3-
C.Na+、Mg2+、AlO2-、SO42-
D.NH4+、ClO-、SO42-、Na+难度: 中等查看答案及解析
-
不能够通过化合反应制得的化合物是( )
A.Al(OH)3
B.Fe(OH)3
C.FeCl2
D.FeSO4难度: 中等查看答案及解析
-
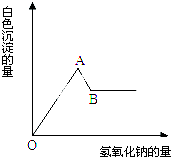
向含有1mol Al2(SO4)3的溶液中加入Ba(OH)2溶液,使SO42-正好完全沉淀,此时生成Al(OH)3的物质的量为( )
A.0 mol
B.1.33 mol
C.1.67 mol
D.2 mol难度: 中等查看答案及解析
-
A、B两种元素是短周期元素,A+和B-离子具有相同的电子层结构,则下列说法中错误的是( )
A.离子半径:A+>B-
B.原子半径:A>B
C.核电荷数:A>B
D.单质的熔点:A>B难度: 中等查看答案及解析
-
根据表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价元素代号 L M Q R T 原子半径/nm 0.160 0.143 0.112 0.104 0.066 主要化合价 +2 +3 +2 +6、-2 -2
A.氢化物的沸点为H2T>H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等难度: 中等查看答案及解析
-
如图为元素周期表短周期的一部分,有关元素X、Y、Z、M的说法不正确的是( )
A.X晶体的结构微粒是原子,故属于原子晶体
B.Y、Z可形成ZY6分子
C.原子半径:Z>M>Y
D.Z离子的结构示意图可表示为:难度: 中等查看答案及解析
-
有机物
 的正确命名为( )
的正确命名为( )
A.2-乙基-3,3-二甲基-4-乙基戊烷
B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷
D.2,3,3-三甲基己烷难度: 中等查看答案及解析
-
0.7g铁粉放入40mL 1mol/L的稀硝酸中,反应停止后溶液中的盐是( )
A.只有Fe(NO3)3
B.只有Fe(NO3)2
C.Fe(NO3)3和Fe(NO3)2
D.不能确定难度: 中等查看答案及解析
-
高温超导体中铊(Tl)是成分之一,已知铊是铝的同族元素,关于铊的性质判断可能错误的是( )
A.铊是银白色质软的金属
B.铊能形成+3价的化合物
C.Tl(OH)3与Al(OH)3一样,具有两性
D.铊可以与稀硝酸反应生成硝酸盐难度: 中等查看答案及解析
-
将一定量的钠和铝的混合粉末投入水中,粉末完全溶解后,得到20mL pH=14的溶液.然后再向其中加入1mol/L的盐酸,到沉淀最大时消耗盐酸40mL,则混合粉末中钠的物质的量是( )
A.0.01mol
B.0.02mol
C.0.03mol
D.0.04mol难度: 中等查看答案及解析
-
200mL 0.1mol•L-1的氯化铁溶液和100mL 0.1mol•L-1的硝酸银溶液混合后,混合溶液中各种离子浓度从大到小的顺序正确的是( )
A.c(Cl-)>c(Fe3+)>c(Ag+)>c(NO3-)
B.c(Cl-)>c(Fe3+)>c(NO3-)>c(Ag+)
C.c(Fe3+)>c(Cl-)>c(NO3-)>c(Ag+)
D.c(NO3-)>c(Fe3+)>c(Ag+)>c(Cl-)难度: 中等查看答案及解析
-
有25mL未知浓度的硫酸溶液,在加入25mL0.5mol/LBa(NO3)2溶液后,改加NaOH溶液,结果用去1.0mol/LNaOH溶液50mL恰好完全中和,则硫酸的浓度是( )
A.0.5mol/L
B.1.0mol/L
C.1.5mol/L
D.2.0mol/L难度: 中等查看答案及解析
-
以下实验能证明某溶液中不含Fe3+而可能含有Fe2+的是( )
A.滴入KSCN溶液,不显红色
B.滴加足量氯水,再加KSCN溶液,显红色
C.滴入KSCN溶液,不显红色,再加氯水,溶液变红
D.滴入KSCN溶液,不显红色,再加足量高锰酸钾溶液,溶液变红难度: 中等查看答案及解析
-
同主族元素所形成的同一类型的化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中不正确的是( )
A.在加热时此化合物可以分解,分解产物为PH3和HI
B.它是一种离子化合物
C.这种化合物能跟强碱发生反应
D.该化合物在一定条件下由PH3与HI化合而成难度: 中等查看答案及解析
-
制印刷电路时,常用FeCl3溶液作为“腐蚀液”发生的化学反应为:2FeCl3+Cu→2FeCl2+CuCl2,向盛有FeCl3和CuCl2混合溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.烧杯中有铜粉无铁粉
B.烧杯中有铜粉、Fe3+、Fe2+,无铁粉
C.烧杯中铁粉铜粉都无
D.烧杯中有Fe3+、Fe2+、Cu2+离子难度: 中等查看答案及解析
-
向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液,使沉淀的物质的量最大时,此时沉淀的物质的量为( )
A.1.25mol
B.2mol
C.2.5mol
D.3mol难度: 中等查看答案及解析