-
在标准状况下进行下列实验:甲、乙各取 30.0ml同浓度的盐酸,加入同一镁-铝合金粉末产生气体,有关数据列表如下:
(1)盐酸的物质的量浓度为______ mol/L,在表中可作为计算依据的是______ (填实验序号,符合要求的全部写出)实验序号 甲 乙 丙 合金质量/mg 255 385 510 气体体积/ml 280 336 336
(2)据______(填实验序号)中的数据,可计算此镁-铝合金中镁与铝的物质的量之比______.
(3)在乙实验中,可以判断______
A、金属过量 B、恰好反应 C、金属不足 D、无法判断
(4)在丙实验之后,向容器中加入一定量的1.00mol/l的NaOH溶液能使合金中的铝粉恰好完全溶解,再过滤出不溶性的固体,请填下表:滤液中的溶质 NaCl NaAlO2 对应物质的量/mol 加入NaOH溶液的体积/ml 高二化学解答题中等难度题查看答案及解析
-
在标准状况下,进行甲、乙、丙三组实验:三组各取60 mL同浓度盐酸,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号
甲
乙
丙
合金质量/mg
510
770
918
气体体积/mL
560
672
672
则下列说法正确的是
A.甲组和乙组的实验中,盐酸均是过量的 B.盐酸的物质的量浓度为0.8 mol/L
C.合金中镁铝的物质的量之比为1∶1 D.丙组中铝的物质的量为0.009 mol
高二化学选择题极难题查看答案及解析
-
在标准状况下,进行甲、乙、丙三组实验:三组各取60 mL同浓度盐酸,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号
甲
乙
丙
合金质量/mg
510
770
918
气体体积/mL
560
672
672
则下列说法正确的是( )
A、甲组和乙组的实验中,盐酸均是过量的
B、盐酸的物质的量浓度为0.8 mol/L
C、合金中镁铝的物质的量之比为1∶1
D、 丙组中铝的物质的量为0.009 mol
高二化学选择题简单题查看答案及解析
-
在标准状况下,进行甲、乙、丙三组实验:三组各取60mL同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号
甲
乙
丙
合金质量/mg
510
770
918
气体体积/mL
560
672
672
则下列说法正确的是
A、甲组和乙组的实验中,盐酸均是过量的
B、盐酸的物质的量浓度为0.8mol·L-1
C、合金中镁铝的物质的量之比为1:1
D、丙组中铝的物质的量为0.015mol
高二化学选择题简单题查看答案及解析
-
在标准状况下,取甲、乙、丙各100mL相同浓度的盐酸,分别加入组成相同的镁,铝合金粉末,得到的气体体积与合金的质量有关数据如下表
(1)反应产生的气体是______,在甲组实验中盐酸______(选填“适量”、“过量”或“不足量”,下同);乙组实验中盐酸______.实验序号 甲 乙 丙 合金质量/g 2.55 3.85 4.59 气体体积/L 2.80 3.36 3.36
(2)盐酸的物质的量浓度为多少?
(3)合金中镁、铝的物质的量之比是多少?高二化学解答题中等难度题查看答案及解析
-
将7.8克镁和铝的混合粉末溶于900ml浓度为1mol/L的盐酸中,完全反应可收集到标准状况下气体8.96升,向反应后的混合溶液中逐滴加入2mol/L的氢氧化钠溶液,试计算:
(1)原金属混合物中含铝___g;
(2)当加入___mL氢氧化钠溶液时,Mg2+、Al3+恰好完全沉淀;
(3)当再加入___mL氢氧化钠溶液时,Al(OH)3恰好完全溶解,此时可得沉淀__克。
高二化学计算题中等难度题查看答案及解析
-
某研究性学习小组同学对由某均匀混合的NaHCO3和KHCO3样品进行实验,测得实验如下图所示
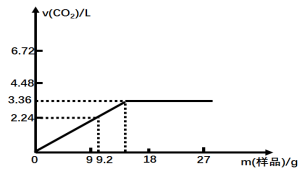
已知:Ⅰ.所测气体体积为标准状况
Ⅱ.盐酸的物质的量浓度相等,且体积均是50mL;试计算:
(1)盐酸的物质的量浓度 mol·L-1。
(2)混合物样品中,NaHCO3与KHCO3的物质的量之比 。
高二化学实验题简单题查看答案及解析
-
某研究性学习小组同学对由某均匀混合的NaHCO3和KHCO3样品进行实验,测得实验如下图所示
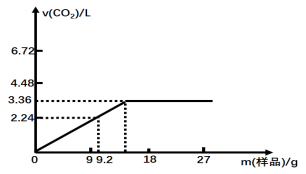
已知:Ⅰ.所测气体体积为标准状况
Ⅱ.盐酸的物质的量浓度相等,且体积均是50mL;试计算:
(1)盐酸的物质的量浓度 mol·L-1。
(2)混合物样品中,NaHCO3与KHCO3的物质的量之比 。
高二化学实验题简单题查看答案及解析
-
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,共产生NO气体4.48 L(标准状况),向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全。则下列有关叙述中不正确的是
A.开始加入合金的物质的量之和为0.3mol
B.反应中被还原和未被还原的硝酸物质的量之比为3∶1
C.沉淀完全时消耗NaOH溶液的体积为200mL
D.生成沉淀的质量比原合金的质量增加10.2g
高二化学选择题困难题查看答案及解析
-
为测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓HNO3中,将合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的pH=0,假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的HNO3的物质的量。
(2)合金中Ag的质量分数。
高二化学计算题中等难度题查看答案及解析