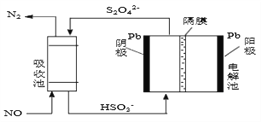
-
下列事实能说明醋酸是弱酸的是( )
①当温度低于 16.6℃时醋酸可凝结成冰一样晶体
②0.1 mol/L 的醋酸钠溶液的 pH 约为 9
③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多
④0.1mol/L 的醋酸的 pH 值约为 4.8
⑤pH 都等于 4 且等体积的醋酸和盐酸,与等浓度 NaOH 溶液充分反应时,醋酸液消耗碱液多
A. ②③④ B. ①②④
C. ②④⑤ D. ②③④⑤
难度: 中等查看答案及解析
-
用0.1000mol·L-1NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.盛装待测液的锥形瓶用蒸馏水洗过,没用待测液润洗
B.酸式滴定管在使用前未用待测液盐酸润洗
C.滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失
D.滴定前读数平视,滴定终点读数时俯视碱式滴定管的刻度
难度: 中等查看答案及解析
-
室温下,下列说法中错误的是( )
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.pH=5的下列溶液①NH4Cl溶液、②CH3COOH溶液、③稀盐酸中由水电离出来的c(H+)水:①>②>③
D.pH相同的下列三种溶液①CH3COONa、②NaHCO3、③NaClO中的c(Na+):①>②>③
难度: 中等查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中,有广泛应用,它的工作原理如下:Cd+2NiO(OH)+2H2O
 Cd(OH)2+2Ni(OH)2.下列叙述正确的是
Cd(OH)2+2Ni(OH)2.下列叙述正确的是A.该电池放电的时候,负极附近pH增大
B.放电时每转移2mol电子,有2mol NiO(OH)被氧化
C.充电时,阳极反应式是Ni(OH)2-e-+OH-=NiO(OH)+H2O
D.充电时,Cd电极接电源正极
难度: 中等查看答案及解析
-
关于下列装置的说法中正确的是( )
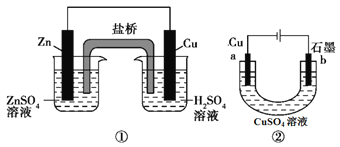
A. 装置①中,盐桥中的Cl- 移向H2SO4溶液
B. 装置②工作一段时间后,可加适量的Cu(OH)2恢复原溶液(原CuSO4溶液足量)
C. 装置①②中的溶液内的H+都在铜电极上被还原,有气泡产生
D. 装置②工作一段时间后,b极附近溶液的pH降低
难度: 中等查看答案及解析
-
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
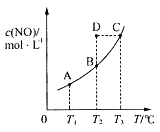
A.该反应的ΔH>0
B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2
C.在T2℃时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
难度: 中等查看答案及解析
-
下列各组溶液中的各种溶质的物质的量浓度均为0.1 mol/L。①H2S溶液;②KHS溶液;③K2S溶液;④H2S和KHS混合溶液(已知常温下KHS溶液的pH>7)。下列说法正确的是( )
A.溶液pH从大到小的顺序是:③ > ② > ① > ④
B.在H2S和KHS混合溶液中有:c(H2S) + c(HS-) + c(S2-) = 2c(K+)
C.c(H2S)从大到小的顺序是:① > ④ > ③ > ②
D.在KHS溶液中有:c(H+) + c(K+) = c(OH-) + c(HS-) + c(S2-)
难度: 中等查看答案及解析
-
COCl2(g)
CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )

① ② ③ ④
A.①表示随温度升高,平衡常数的变化
B.②表示加入催化剂,反应速率随时间的变化
C.③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化
D.④表示CO的体积分数随充入Cl2量的变化
难度: 中等查看答案及解析
-
容积固定为3L的某密闭容器中加入1mol A、2mol B,一定温度下发生如下发应:A(s)+2B(g)
C(g)+D(g),经反应5 min后,测得C的浓度为0.3mol·L-1 。则下列说法正确的是
A.5 min 内D的平均反应速率为0.02 mol·L-1·min-1
B.第5min时C的反应速率为0.06 mol·L-1·min-1
C.经5min后,向容器内再加入A,正反应速率变大
D.平衡状态时,生成1molD时同时生成1molA
难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g)
2HI(g)+9.48kJ (ii)I2(s)+H2(g)
2HI(g)-26.48kJ
下列判断正确的是( )
A.
中通入
,反应放热
B.
固态碘与
气态碘所含的能量相差
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 中等查看答案及解析
-
某温度下,在一个2L的密闭容器中,加入4mo1A和2molB进行如下反应:3A(g)+2B(g)
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6molC,且反应的前后的压强之比为5:4(相同的温度下测量)。则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=
B.此时,B 的平衡转化率是35%
C.增加C的量,B的平衡转化率不变
D.增大该体系的压强,平衡向右移动,化学平衡常数增大
难度: 中等查看答案及解析
-
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
难度: 简单查看答案及解析
-
在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
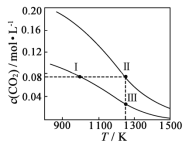
A.反应CO2(g)+C(s)
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
难度: 中等查看答案及解析
-
25 ℃时,氢离子浓度都为1×10-2 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入003 g Zn粉,在相同条件下充分反应,下列有关叙述正确的是
A.稀释2倍后,两溶液的pH:盐酸小于醋酸
B.盐酸和醋酸分别与Zn反应放出的氢气一样多
C.盐酸和醋酸分别与Zn反应的速率一样大
D.稀释2倍前,醋酸溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)
难度: 中等查看答案及解析
-
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法不正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH降低
C.阳极反应方程式为:2Cl--2e-=Cl2↑
D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子
难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH =+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
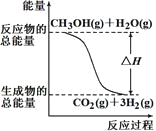
根据上述反应,下列说法正确的是
A.反应①中的能量变化如图所示
B.可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D.CH3OH转变成H2的过程一定要吸收能量
难度: 简单查看答案及解析