-
醋酸溶液中存在电离平衡:CH3COOH
H++CH3COO⁻,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.0.10 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)增大。
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸。
难度: 简单查看答案及解析
-
已知:X(g)+2Y(g)
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
A.0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C.达到化学平衡状态时,反应放出的总热量可达a kJ
D.升高反应温度,逆反应速率增大,正反应速率减小
难度: 简单查看答案及解析
-
某温度下,在一个2L的密闭容器中,加入4molX和2molY进行如下反应:3X(g)+2Y(g)
4Z(s)+2W(g),反应一段时间后达到平衡,测得生成1.6molZ,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=
B.此时,Y的平衡转化率是40%
C.增大该体系的压强,化学平衡常数增大
D.增加Y,Y的平衡转化率增大
难度: 中等查看答案及解析
-
已知:Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H1
2H2O2(l)=2H2O(l)+O2(g) △H2
2H2(g)+O2(g)=2H2O(l) △H3
则反应Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l))的△H是( )
A. △H=△H1+1/2△H2+1/2△H3
B. △H=△H1+1/2△H2-1/2△H3
C. △H=△H1+2△H2+2△H3
D. △H=2△H1+△H2+△H3
难度: 中等查看答案及解析
-
在密闭容器中加入CaSO4和CO,在一定温度下,发生反应:CaSO4(s)+CO(g)
CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1
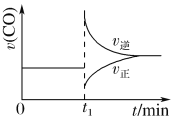
CO的反应速率随时间变化如图所示。下列说法正确的是( )
A.该反应是吸热反应,升高温度,正反应速率增大,逆反应速率减小
B.CaO是固态,不能用CaO表示反应的快慢
C.图示中t1时改变的条件可能是减小c(CO),同时增大c(SO2)
D.图示中t1时改变的条件可能是增大压强
难度: 简单查看答案及解析
-
某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是( )
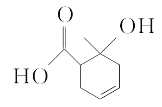
A.能和碳酸氢钠溶液反应的官能团有2种
B.1 mol该有机物最多能与2 mol H2发生加成反应
C.与
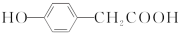 互为同分异构体
互为同分异构体D.既可以发生取代反应又可以发生氧化反应
难度: 简单查看答案及解析
-
2017年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法应提倡的是( )
A.夏天设定空调温度尽可能的低 B.推广使用一次性塑料袋和纸巾
C.少开私家车多乘公共交通工具 D.对商品进行豪华包装促进销售
难度: 中等查看答案及解析
-
不属于电离方程式的是( )
A.CH3COOH + H2O
CH3COO-+H3O+
B.NH3·H2O
NH
+OH-
C.2H2O
H3O++OH-
D.CO
+H+=HCO
难度: 简单查看答案及解析
-
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
非电解质
C12H22O11(蔗糖)
BaSO4
C2H5OH
H2O
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1。则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1
B.CO(g)的燃烧热ΔH是-283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+(2×283.0) kJ·mol-1
C.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
难度: 简单查看答案及解析
-
下列叙述中错误的是( )
A.熔融状态下NaHSO4电离方程式为:NaHSO4(熔融)=Na++HSO
。
B.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
C.1 mol·L-1的醋酸溶液中c(H+)=0.01 mol·L-1可以证明醋酸是弱电解质
D.HF、HCl、BaSO4都是强电解质
难度: 简单查看答案及解析
-
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:HA
A-+H+,要使溶液中
的比值增大,可以采取的措施是( )
A.加少量烧碱溶液 B.加NaA(s)
C.加少量HA D.加水
难度: 简单查看答案及解析
-
稀氨水中存在着下列平衡:NH3·H2O
NH
+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热⑥加入少量MgSO4固体
A.①②③⑤ B.③⑥ C.③ D.③⑤
难度: 简单查看答案及解析
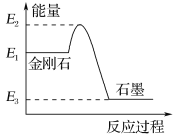
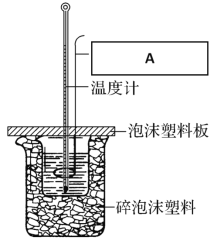
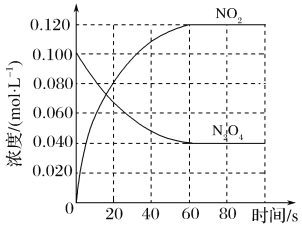
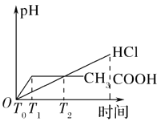 B.
B. 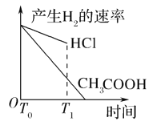
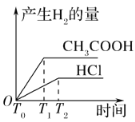 D.
D. 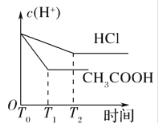
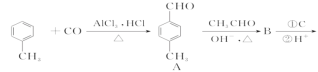

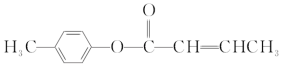 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________________________________________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________________________________________________。