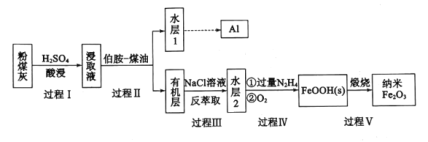
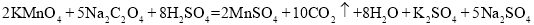-
化学在2020年抗击新型冠状病毒肺炎的战役中发挥了巨大作用。下列说法错误的是
A.防控新冠病毒所用的酒精浓度越大,消毒效果越好
B.防护服、口罩的生产均要用到有机高分子材料
C.过氧化氢、过氧乙酸、84消毒液、二氧化氯泡腾片都可用于环境消毒
D.冷链运输抗病毒疫苗的目的是避免蛋白质变性
难度: 简单查看答案及解析
-
下列有机物命名正确的是
A.
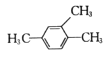 1,3,4—三甲苯 B.
1,3,4—三甲苯 B.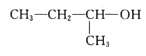 2—甲基—1—丙醇
2—甲基—1—丙醇C.
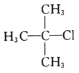 2—甲基—2—氯丙烷 D.
2—甲基—2—氯丙烷 D.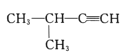 2—甲基—3—丁炔
2—甲基—3—丁炔难度: 简单查看答案及解析
-
表示阿伏加德罗常数的值,工业制备硝酸的过程中发生反应
。下列说法正确的是
A.室温下,22.4LNO2中所含原子总数为
B.36g
中含有
键的总数为
C.标准状况下,11.2LNO中所含电子总数为
D.上述反应中,生成1mol
转移电子的数目为
难度: 简单查看答案及解析
-
现代污水处理工艺中常利用聚合铁在水体中形成絮状物,以吸附
等重金属离子,聚合铁简称PFS,化学式为
。下列说法错误的是
元素
Mn
Fe
电离能/kJ·mol-1
717
762
1509
1561
3248
2957
A.PFS中铁元素显+3价
B.基态铁原子的价电子排布式为
C.由
溶液制备PFS需经过氧化、水解和聚合等过程
D.由表可知再失去一个电子时,气态
比气态
难
难度: 简单查看答案及解析
-
下列实验不能达到实验目的的是
A
B
C
D
实验
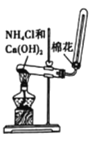
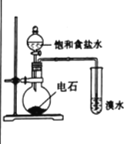
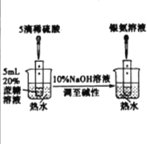
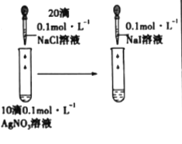
实验目的
实验室制取氨气
证明乙炔可使溴水褪色
检验蔗糖的水解产物具有还原性
证明溶解度:
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
M、W、X、Y、Z是同周期主族元素,X原子的最外层电子数是W原子次外层电子数的3倍。它们形成的化合物可用作新型电池的电极材料,结构如图所示,化合物中除
外其它原子均满足8电子稳定结构。下列说法正确的是
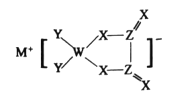
A.M的单质通常保存在煤油中 B.W的最高价氧化物对应的水化物是一元弱酸
C.简单气态氢化物稳定性X>Y D.上述五种元素中Z的电负性最大
难度: 中等查看答案及解析
-
工业上制备有机氟化剂
的反应
。下列说法正确的是
A.NaF既不做氧化剂也不做还原剂,
为氧化产物
B.
与
两种物质中的氯元素化合价不同
C.还原剂与氧化剂物质的量之比为2:1
D.
属于有机物
难度: 简单查看答案及解析
-
下图是以秸秆为原料制备某种聚酯高分子化合物的合成路线:
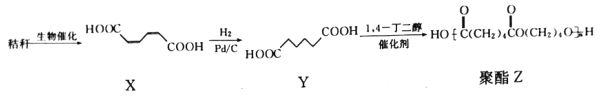
下列有关说法正确的是
A.X的化学式为C4H6O4
B.Y分子中有1个手性碳原子
C.生成聚酯Z的反应类型为加聚反应
D.制备聚酯Z,消耗Y和1,4-丁二醇的物质的量之比为1:1
难度: 中等查看答案及解析
-
下列有关实验操作对应的现象及结论都正确且二者存在因果关系的是
选项
实验
现象
结论
A
向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4溶液和KMnO4溶液
两者产生气泡的速率不同
CuSO4和KMnO4对H2O2分解反应的催化效果不同
B
向植物油和矿物油中分别加入烧碱溶液,加热
冷却后观察到其一分层,另一不分层
分层的是矿物油,不分层的植物油发生了水解反应且水解产物溶于水
C
将浓硝酸滴到胆矾晶体表面
晶体表面出现白斑
浓硝酸具有脱水性
D
向饱和NaHCO3溶液中滴入Na[Al(OH)4]溶液
产生白色沉淀
增大c(Na+)促使NaHCO3结晶析出
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
炭黑是雾霾中的重要颗粒物之一,研究发现它可以活化氧分子生成活化氧,活化氧可以快速氧化二氧化硫。活化过程的能量变化模拟计算结果如图所示,下列说法错误的是
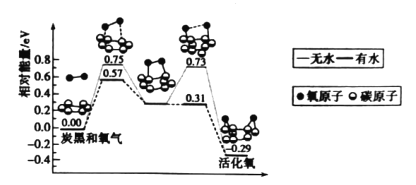
A.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
B.氧分子的活化包括O-O键的断裂与C-O键的生成
C.水可使氧分子活化反应的活化能降低0.42 eV
D.每活化一个氧分子放出0.29 eV的能量
难度: 中等查看答案及解析
-
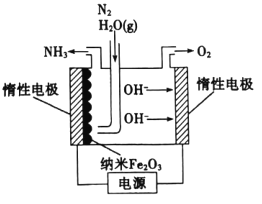
我国科学家设计了一种太阳能驱动从海水中提取金属锂的装置,示意图如图所示。该装置工作时,下列说法正确的是

A.铜箔上的电势比催化电极上的高
B.海水的pH变大
C.若转移1mol电子,理论上铜箔增重7g
D.固体陶瓷膜可用质子交换膜代替
难度: 困难查看答案及解析
-
实验室从含碘废液(含有I2、I-等)中回收碘,其实验过程如下:
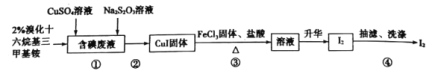
己知:溴化十六烷基三甲基铵是一种阳离子表面活性剂,可以中和沉淀表面所带的负电荷,使沉淀颗粒快速聚集,快速下沉。下列说法错误的是
A.含碘废液中是否含有IO3-,可用KI-淀粉试纸检验
B.步骤①中Na2S2O3可用Na2SO3代替
C.步骤②可以用倾析法除去上层清液
D.步骤③发生反应的离子方程式为:4Fe3++2CuI
4Fe2++2Cu2++I2
难度: 中等查看答案及解析
-
据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述错误的是
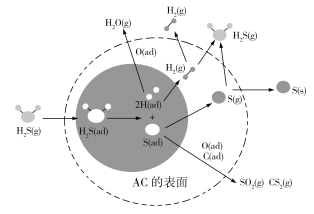
A.图中阴影部分表示H2S分子的吸附与离解
B.AC表面作用的温度不同,H2S的去除率不同
C.H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等
D.图中反应过程中只有H—S键的断裂,没有H—S键的形成
难度: 简单查看答案及解析

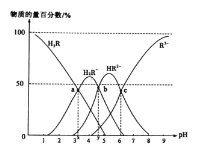
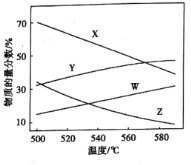
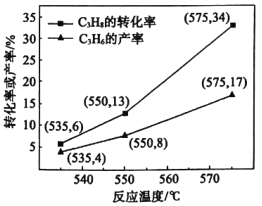
 )
)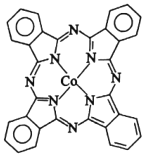
 C
C 
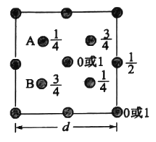
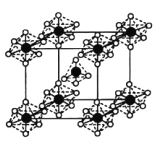
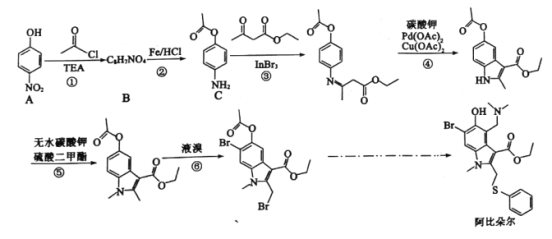
 的合成路线_______(其它无机试剂任选)
的合成路线_______(其它无机试剂任选)