-
化学在疫情防控中发挥着重要作用,下列说法不正确的是( )
A.二氧化氯可用于自来水消毒
B.医用消毒酒精是95%的乙醇溶液
C.医用防护口罩的材料之一是聚丙烯,聚丙烯属于高分子材料
D.84消毒液和酒精混合消毒作用减弱,可能发生了复杂的化学反应
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.最高正化合价: O>N>C B.第一电离能: Na<Mg<Al
C.电负性: O>S>Se D.晶体类型相同: CO2 SiO2 GeO2
难度: 中等查看答案及解析
-
下列反应的离子方程式书写不正确的是( )
A.澄清石灰水与少量小苏打溶液混合: Ca2++OH-+
═CaCO3↓+H2O
B.向FeBr2溶液中通入足量的氯气: 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
C.向NaAlO2溶液中滴加少量NaHCO3溶液:
+
+H2O=Al(OH)3↓+
D.用铁电极电解饱和食盐水 2Cl-+2H2O == 2OH-+H2↑+Cl2↑
难度: 中等查看答案及解析
-
某有机物A的结构简式如图所示,下列有关叙述正确的是( )
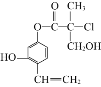
A.1molA最多可以与2molBr2发生反应
B.一个A分子中最多有8个碳原子在同一平面上
C.1molA与足量的NaOH溶液反应,最多可以消耗3molNaOH
D.在一定条件下可以发生消去反应和取代反应
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.12g金刚石中含有碳碳单键的数目为2NA
B.2molNa218O2与足量水反应,最终水溶液中18O原子数为NA
C.惰性电极电解AgNO3溶液,两极均产生0.5mol气体时,电路中通过电子数为NA
D.标准状况下,11.2LCHC13中含有的氯原子数目为1.5NA.
难度: 中等查看答案及解析
-
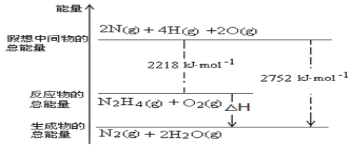
如图是某元素的价类二维图。其中X是一种强碱,G为正盐,通常条件下Z是无色液体,D的相对原子质量比C小16,各物质转化关系如图所示。下列说法正确的是( )
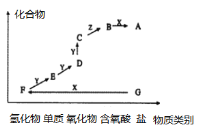
A.D气体一般用排空气法收集 B.F和Y在一定条件下不能直接生成C
C.A的水溶液呈酸性 D.E→D可用于检验D
难度: 中等查看答案及解析
-
下列由实验得出的结论正确的是( )
实验
结论
A
相同条件下,测定等浓度的Na2CO3溶液和Na2SO4溶液的pH,前者呈碱性,后者呈中性。
非金属性:S>C
B
将醋酸与碳酸钠反应产生的二氧化碳气体直接通入苯酚钠溶液中,产生白色浑浊。
CH3COOH>H2CO3>C6H5OH
C
向蔗糖溶液中滴加稀硫酸,加热,然后加入新制Cu(OH)2悬浊液,加热,未观察到砖红色沉淀。
蔗糖未水解或水解的产物不是还原性糖
D
将CH3CH2Br与氢氧化钠的醇溶液共热产生的气体通入酸性高锰酸钾溶液,褪色。
产生乙烯气体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
25℃时,浓度均为0.1mol·L-1的溶液,其pH如表所示。有关说法正确的是
序号
①
②
③
④
溶液
NaCl
CH3COONH4
NaF
NaHCO3
pH
7.0
7.0
8.1
8.4
A.酸性强弱:H2CO3>HF B.①和②中水的电离程度相同
C.离子的总浓度:①>③ D.④中:c(HCO3-)+2c(CO32-)+c(H2CO3)=0.1mol·L-1
难度: 中等查看答案及解析
-
工业上常用还原沉淀法处理含铬废水(
和
),其流程为:
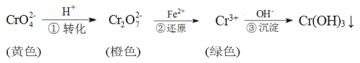
已知:步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)Ksp=c(Cr3+)·c3(OH-)=10-32
下列有关说法正确的是( )
A.步骤①中当2v正(
)=v逆(
)时,说明反应:2
+2H+⇌
+H2O达到平衡状态
B.
在酸性溶液中不能大量存在
C.步骤②中,若要还原1mol
离子,需要12mol(NH4)2Fe(SO4)2
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10-5 mol/L时,可视作该离子沉淀完全)
难度: 中等查看答案及解析
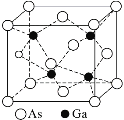
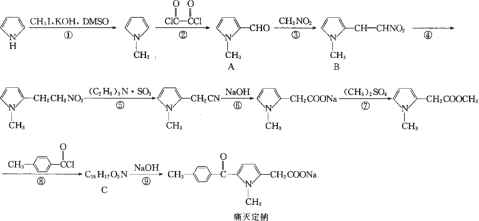
 的合成路线图___。
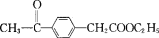
的合成路线图___。