-
I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
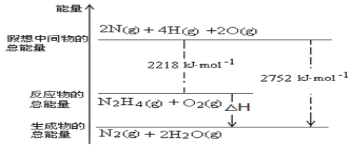
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为 __________ 。
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲____________V丙,平衡常数K丙_________K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)⇌ H2NCOONH4(氨基甲酸铵)(l) △H1 ,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
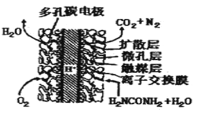
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________。
-
氮是地球上含量丰富的一种元素,氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
Ⅰ.(1)N2H4中的N原子最外层达到8电子稳定结构,写出N2H4的结构式_____________。

(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为________。
(3)肼是一种高能燃料,有关化学反应的能量变化如右图所示,写出肼燃烧的热化学方程式________。
Ⅱ.氨的合成是最重要的化工生产之一。已知:
N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1
在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:

试回答:
(1)下列各项能说明该反应已达到平衡状态的是______________(填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)分析上表数据,下列关系正确的是_________(填写序号字母)。
A.2c1>1.5mol·L-1 B.w3=w1 C.2ρ1=ρ2 D.K甲= K乙= K丙
(3)容器乙中反应从开始到达平衡平均速率为v(H2)= _____________。
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是__________ 。
-
(14分)氮是地球上极为丰富的元素,氮元素可形成多种离子,如:N3—、N3—、NH2—、NH4+、N2H5+、N2H62+等。
(1)请画出氮的原子结构示意图___________。
(2)氮的常见氢化物的结构式为________,其空间构型为_______,它极易溶于水的主要原因是_________________,溶于水后显碱性的原因是_______________(用离子方程式说明)
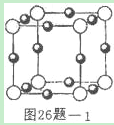
(3)X+中所有电子正好充满K、L两个电子层,它与N3—形成的晶体结构如图26题 l所示。与同一个N3—相连的X+有________个,X的元素符号是________。
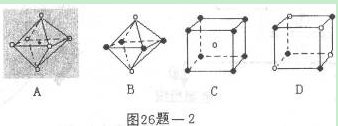
(4)最近科学家研制出某元素Z与N元素形成的晶体ZN,已知ZN晶体具有与NaCI相似的晶体结构。图26题-2是从ZN晶体结构图中分割出来的部分结构图,试判断符合ZN晶体结构图的是_______________。
-
运载火箭常用偏二甲肼(C2H8N2)(其中N的化合价为-3)作燃料和四氧化二氮(N2O4)反应。在火箭升空过程中,燃料发生反应:C2H8N2+2N2O4 2CO2+3N2+4H2O提供能量。下列有关叙述正确的是
2CO2+3N2+4H2O提供能量。下列有关叙述正确的是
A. 该燃料绿色环保,在燃烧过程中不会造成任何环境污染
B. 该反应中N2O4是氧化剂,偏二甲肼是还原剂
C. N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物
D. 每有0.6 mol N2生成,转移电子数目为2.4NA
-
氮是地球上含量丰富的一种元素,氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物,在工农业生产、生活中有着重大作用。
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)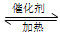 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。

③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解 可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。
-
(本题12分)
氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。铵盐在工农业生产、生活中有着重大作用。
 完成下列填空
完成下列填空
(1).在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g) 2NH3(g),其平衡常数K与温度T的关系如下表。
| T/K | 298 | 398 | 498 | …… |
| 平衡常数K | 4.1×106 | K1 | K2 | …… |
则该反应的平衡常数K1________K2 (填“>”、“<”或“=”)。
(2).能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:
(3).相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中的c(NH4+)。
(4).如图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
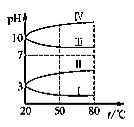
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填写序号),
导致pH随温度变化的原因是_______________________________;
②20℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__________。
(5).室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示。
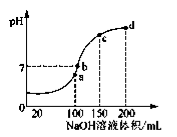
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________。
-
氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
| | | | | |
(1)①分析数据可知:大气固氮反应属于___________(填“吸热”或“放热”)反应。
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_______。
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③ 从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:________。
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮。
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是____________(填“A” 或“B”);比较P1、P2的大小关系________;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=______________ (计算结果保留2位有效数字)。
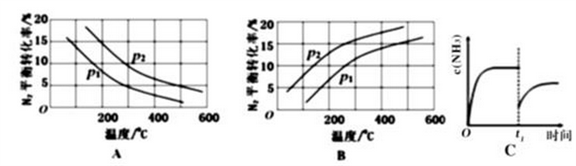
③合成氨反应达到平衡后,t1时刻氨气浓度欲发生图C变化可采取的措施是____________。
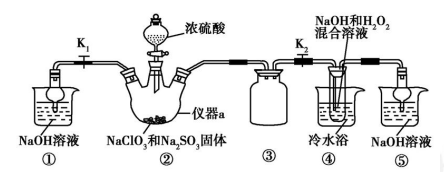
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),则其反应热△H=____________。
(已知:N2(g)+3H2(g)⇌2NH3(g) △H1=-92.4kJ•mol-1;2H2(g)+O2(g)⇌2H2O(l) △H2=-571.6kJ•mol-1 )
-
氮是地球上含量丰富的一种元素,“固氮”在工农业生产中有着重要作用,是几百年来科学家一直研究的课题。下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 | 大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) | 工业固氮 N2(g)+3H2(g)  2NH3(g) 2NH3(g) |
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×10-8 | 2×104 | 7×103 |
| | | | | |
(1)①分析数据可知:大气固氮反应属于_______(填“吸热”或“放热”)反应。
②在一定温度下,将一定足的N2和O2通入到体积为1L的密闭容器中,当“大气固氮”反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是_______。
a.增大压强 b.增大反应物的浓度 c.使用催化剂 d.升高温度
③ 从分子结构角度解释“大气固氮”和“工业固氮”反应的活化能都很高的原因:__________________。
(2)分析表格数据可知“大气固氮”的反应正向进行的程度小,不适合大规模生产,故世界各国均采用合成氨的方法进行工业固氮。
①从平衡移动角度考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
②将0.1molN2和0.1molH2通入一容积可变的容器中进行工业固氮反应,则下图所示N2的平衡转化率在不同压强(P1,P2)下随温度变化的曲线正确的是_(填“A” 或“B”);比较P1、P2的大小关系__________;若300℃、压强P2时达到平衡,容器容积恰为100L,则此状态下反应的平衡常数K=__________(计算结果保留2位有效数字)。

③合成氨反应达到平衡后,t1时刻氮气浓度欲发生图C变化可采取的措施是__________。
(3)近年近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,
反应原理为:2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g),则其反应热△H=____________。
(已知:N2(g)+3H2(g)⇌2NH3(g) △H1=-92.4kJ•mol-1
2H2(g)+O2(g)⇌2H2O(l) △H2=-571.6kJ•mol-1 )
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列关于氮元素的有关问题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ;⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g);⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) ; △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式________,该反应的熵变⊿S________0(填“>”、“<”、“="”" )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
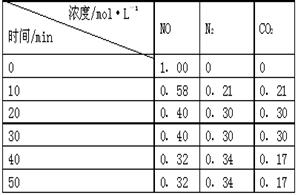
①10min~20min以V(CO2) 表示的反应速率为 ________。
②该反应的平衡常数的表达式为:K=________,根据表中数据,计算T1℃时该反应的平衡常数为________ ________(保留两位小数)。
③下列各项能作为判断该反应达到平衡的是________(填序号字母)。
a.容器内压强保持不变 b.2V(NO)(正)= V(N2)(逆)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是________。
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率________(填“增大”、“不变”或“减小”) 。
-
氮元素在地球上含量丰富,氮及其化合物在工农业生产、日常生活中有着重要作用。下列叙述与氮元素的循环无关的是 ( )
A.工业合成氨的过程是固氮的过程
B.自然界中,氨是动物体内蛋白质腐败后的产物
C.为防止粮食、罐头、水果等食品腐烂,常用氮气作保护气
D.在电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收






 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。





