-
下列能源中,蕴藏有限、不能再生的是
A. 氢能 B. 太阳能 C. 地热能 D. 化石燃料
难度: 简单查看答案及解析
-
实施垃圾分类,节约使用资源是社会文明水平的重要体现,废旧电池属于
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
下列食品添加剂中,其使用目的与反应速率有关的是
A.防腐剂 B.调味剂 C.着色剂 D.营养强化剂
难度: 简单查看答案及解析
-
下列物质溶于水后主要以分子形式存在的是
A.H2SO4 B.NaOH C.CH3COOH D.CH3COONa
难度: 中等查看答案及解析
-
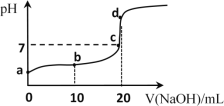
下列离子方程式中,属于水解反应的是
A.HCOOH⇌HCOO-+H+
B.
+H2O⇌H2CO3+OH-
C.H2O+H2O⇌H3O++OH-
D.
⇌
+H+
难度: 简单查看答案及解析
-
一定条件下,在10L密闭容器中发生反应:A(g)+3B(g)=2C(g)+4D(g),测得5min内,A的物质的量减小了10mol,则5min内该反应的化学反应速率是
A.υ(A)=2.0mol/(L·min)
B.υ(B)=0.2mol/(L·min)
C.υ(C)=0.2mol/(L·min)
D.υ(D)=0.8mol/(L·min)
难度: 简单查看答案及解析
-
在一定温度下的恒容密闭容器中发生反应:2SO2(g)+O2(g)
2SO3(g),下列证据不能说明反应一定达到化学平衡状态的是( )
A.容器内的压强不再改变 B.c(SO2):c(O2):c(SO3)=2:1:2
C.SO2的转化率不再改变 D.SO3的生成速率与SO3的消耗速率相等
难度: 中等查看答案及解析
-
在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O发生反应: CO(g)+H2O(g)
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的
A. 在该温度下平衡常数K=1 B. 平衡常数与反应温度无关
C. CO的转化率为50% D. 其他条件不变,改变压强平衡不移动
难度: 中等查看答案及解析
-
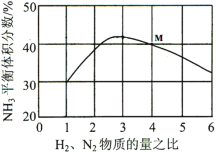
N2和O2生成NO的反应在密闭容器中进行,下列条件中一定能够加快化学反应速率的是
A.扩大体积
B.体积不变,充入N2
C.扩大体积,充入氦气
D.体积不变,充入氦气,增大压强
难度: 中等查看答案及解析
-
下列事实能说明醋酸是弱电解质的是
A.醋酸溶液能使石蕊溶液变红
B.25℃时,0.1mol/L醋酸溶液的pH约为3
C.醋酸能与乙醇反应生成乙酸乙酯
D.醋酸能与水以任意比互溶
难度: 简单查看答案及解析
-
下列金属防护的方法中,应用了牺牲阳极的阴极保护法的是
A
B
C
D




工具转动部位涂油脂
钢铁船身嵌入锌
车圈、车铃钢上镀铬
健身器材刷油漆
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
0.1mol/L的NH4Cl溶液中,离子浓度关系正确的是
A.c(
)>c(Cl—)>c(H+)>c(OH—)
B.c(
)>c(OH—)>c(Cl—)>c(H+)
C.c(OH—)=c(Cl—)+c(H+)
D.c(
)+c(H+)=c(Cl—)+c(OH—)
难度: 简单查看答案及解析
-
下列应用与盐类水解无关的是
A.纯碱溶液去油污
B.明矾做净水剂
C.用氯化铁溶液制氢氧化铁胶体
D.用Na2S做沉淀剂,除去溶液中的Cu2+
难度: 简单查看答案及解析
-
下列事实不能用平衡移动原理解释的是
A.
 开启啤酒瓶后,瓶中马上泛起大量泡沫
开启啤酒瓶后,瓶中马上泛起大量泡沫B.
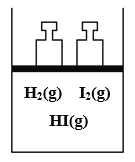 由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深
由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深C.
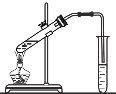 实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出D.
 石灰岩受地下水长期溶蚀形成溶洞
石灰岩受地下水长期溶蚀形成溶洞难度: 中等查看答案及解析
-
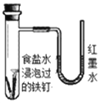
下列解释事实的离子方程式不正确的是
A.用石墨电极电解饱和食盐水:2Cl-+2H2O
2OH-+H2↑+Cl2↑
B.明矾可以做净水剂:Al3++3H2O=Al(OH)3↓+3H+
C.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=Cu
D.向氢氧化镁浊液中滴入酚酞溶液,溶液变红:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq)
难度: 中等查看答案及解析
-
一定条件下的可逆反应:A(g)+3B(g)⇌2C(g)ΔH=-akJ·mol−1。下列说法正确的是
A.该反应达到最大限度时,c(C)=2c(A)
B.容器压强不变,充入少量Ar气(Ar气与A、B、C气体都不反应),平衡不移动
C.降温,由于反应的化学平衡常数(K)改变,使Qc<K,平衡发生移动
D.该条件下,将1molA和足量B投入密闭容器中充分反应,放出akJ的热量
难度: 简单查看答案及解析
-
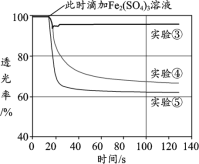
环戊二烯容易发生聚合生成二聚体,该反应为:2
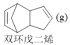 ΔH<0。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法不正确的是
ΔH<0。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法不正确的是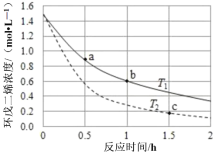
A.T1<T2
B.a点的正反应速率大于b点的逆反应速率
C.达平衡后,T1温度下环戊二烯的浓度大于T2温度下环戊二烯的浓度
D.反应开始至b点时,双环戊二烯平均速率约为:0.45mol•L-1•h-1
难度: 中等查看答案及解析
-
多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
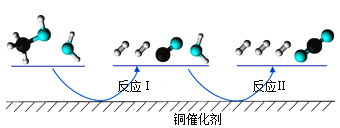

下列说法正确的是( )
A.反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.选择优良的催化剂降低反应Ⅰ和Ⅱ的活化能,有利于减少过程中的能耗
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
难度: 简单查看答案及解析
-
下列实验方案中,不能达到相应实验目的的是
选项
A
B
C
D
实验方案
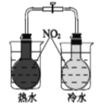
目的
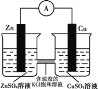
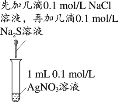
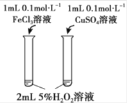
研究温度对化学平衡的影响
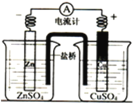
验证锌与硫酸铜反应过程中有电子转移
证明溶解度:AgCl>Ag2S
比较不同催化剂对化学反应速率的影响
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
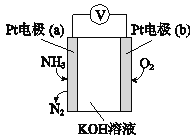
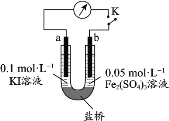
第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态,其电路工作原理如图所示。下列说法中正确的是
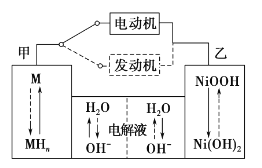
A.放电时甲为负极,充电时为阳极
B.放电时负极的电极反应式为:MHn-ne-=M+nH+
C.电池充电时,OH-由甲侧向乙侧移动
D.汽车下坡时发生图中实线所示的过程
难度: 困难查看答案及解析
-
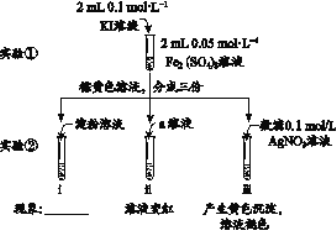
为探究浓度对化学平衡的影响,某同学进行如下实验:下列说法不正确的是:
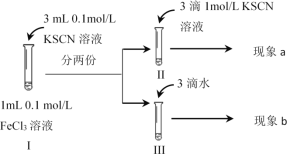
A.该实验通过观察颜色变化以判断生成物浓度的变化
B.观察到现象a比现象b中红色更深,即可证明增加反应物浓度,平衡正向移动
C.进行II、III对比实验的主要目的是防止由于溶液体积变化引起各离子浓度变化而干扰实验结论得出
D.若I中加入KSCN溶液的体积改为2mL也可以达到实验目的
难度: 简单查看答案及解析