-
为探究化学反应“2Fe3++2I-⇌2Fe2++I2”存在限度及平衡移动与物质的浓度、性质的关系,甲、乙两同学进行如下实验。
已知:a.含I2的溶液呈黄色或棕黄色。b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
Ⅰ.甲同学设计下列实验进行相关探究,实验如下:
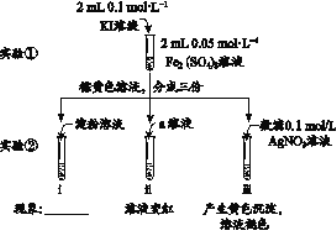
回答下列问题:
(1)甲同学利用实验②中i和ii证明Fe2(SO4)3溶液与KI溶液的反应存在限度,实验i中的现象是________,实验ii中a是________(化学式)溶液。
(2)用离子方程式表示实验②iii中产生黄色沉淀的原因________。
Ⅱ.乙同学:利用色度计对Fe2(SO4)3溶液与KI溶液的反应进行再次探究
(实验过程)
| 序号 | 实验步骤1 | 实验步骤2 |
| 实验③ | 将盛有2mL蒸馏水的比色皿放入色度计的槽孔中 | 向比色皿中逐滴滴入5滴(每滴约0.025mL)0.05mol·L-1Fe2(SO4)3溶液,同时采集溶液的透光率数据 |
| 实验④ | 将盛有2mL0.1mol·L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |
| 实验⑤ | 将盛有2mL0.2mol·L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |
实验中溶液的透光率数据变化如图所示:
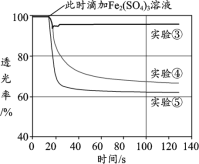
回答下列问题:
(3)乙同学实验③的目的是______。
(4)乙同学通过透光率变化推断:FeCl3溶液与KI溶液的反应存在限度。其相应的推理过程是______。
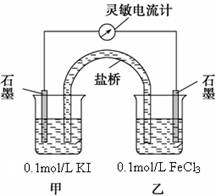
(5)乙同学根据氧化还原反应的规律,用如图装置(a、b均为石墨电极),探究化学平衡移动与I-与Fe2+浓度及还原性强弱关系,操作过程如下:
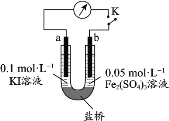
①K闭合时,电流计指针向右偏转,乙同学得出结论:2Fe3++2I—⇌2Fe2++I2向正反应方向进行,b作______(填“正”或“负”)极,还原性I—>Fe2+。
②当指针归零(反应达到平衡)后,向U型管右管滴加0.1mol/LFeSO4溶液,电流计指针向左偏转,由此得出还原性Fe2+_____I—(填“>”或“<”)。
(6)综合甲、乙两位同学的实验探究过程,得出的结论有______。
-
探究浓度对2Fe3+ + 2I-⇌2Fe2+ + I2 的影响,进行如下实验:
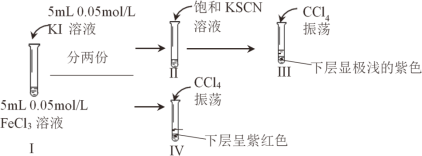
下列说法不正确的是
A.Ⅱ中加入的 SCN-结合Fe3+使平衡向左移动
B.Ⅲ中含有 I2
C.比较水溶液中的 c(I-):II>Ⅳ
D.比较水溶液中的 c(Fe3+):Ⅳ>I
-
(11分)某研究性学习小组为证明2Fe3+ + 2I-  2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
按要求回答下列问题。
方案甲:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,再继续加入2mL CCl4,充分振荡。静置、分层,再取上层清液,滴加KSCN溶液。
(1)甲方案中能证明该反应为可逆反应的现象是________。
(2)有同学认为该方案设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是。
方案乙:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,溶液呈棕黄色,再往溶液中滴加NH4F溶液,若看到________现象,即可证明该反应为可逆反应,请解释产生该现象的原因________。
方案丙:
设计如图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在乙烧杯中加入1mol/L FeCl2溶液,若观察到灵敏电流计的指针向________方向偏转(填“左”、“右”或“不移动”),即可判断该反应为可逆反应,此时甲中石墨电极上的电极反应式为________________________。
【解析】(1)根据实验数据可知碘化钾是过量的,若反应是可逆反应,则溶液中一定存在铁离子,同时也必须生成单质碘。所以可以通过检验铁离子和单质碘来证明。
(2)因为碘离子和亚铁离子在空气中也可以被氧气氧化生成单质碘和铁离子,所以方案不是很严密。
(3)可以依据外界条件对平衡的影响来验证。因为Fe3+与F-络合生成无色的FeF63-,促使2Fe3+ + 2I-  2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
(4)在原电池中负极是失去电子的,碘离子失去电子,所以电子是从甲池流向乙池,所以电流计的指针向左偏转。
-
某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL 0.1mol/L KI溶液于试管中,滴加0.1mol/L FeCl3溶液2mL,发生如下反应:2Fe3++2I- 2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验中①不合理,你认为是_____________________________;在不改变反应物用量的前提下,改进的方法是_____________________________________________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是______________________________。
(3)控制适合的条件,将反应2Fe3++2I- 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。
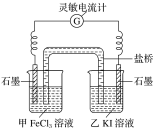
①反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为_________________________。
②电流计读数为0时,反应达到平衡状态。此时在甲中加入FeCl2固体,发现电流计又发生偏转,则甲中的石墨作_______(填“正”或“负”)极,该电极的电极反应式为_________________________。
-
某兴趣小组在实验室设计如下实验研究2Fe3++ 2I-= 2Fe2+ +I2的反应。
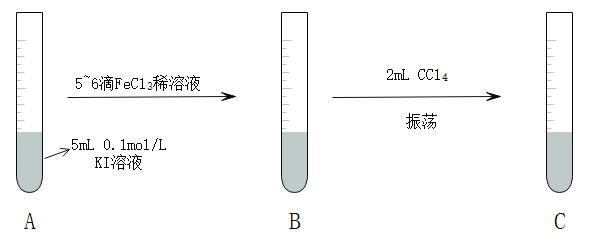
(1)振荡静置后C中观察到的现象是____; 为证明该反应存在一定限度,还应补做实验为:取C中分液后的上层溶液然后____ (写出实验操作和现象)。
(2)测定上述KI溶液的浓度,进行以下操作:
I.用移液管移取20.00mL KI溶液至锥形瓶中,加入适量稀硫酸酸化,再加入足量H2O2溶液,充分反应。
Ⅱ.小心加热除去过量的H2O2。
Ⅲ.用淀粉做指示剂,用cmol/L Na2S2O3标准溶液滴定,反应原理为:2 Na2S2O3+ I2=2Na1+Na2SO4
①步骤II是否可省略? ____ (答“可以”或“不可以”)
②步骤川达到滴定终点的现象是____。
③已知I2浓度很高时,会与淀粉形成稳定的包合物不易解离,为避免引起实验误差,加指示剂的最佳时机是____。
-
某兴趣小组在实验室进行如下实验探究活动。
(1)设计如下实验研究2Fe3++2I- 2Fe2++I2的反应。
2Fe2++I2的反应。
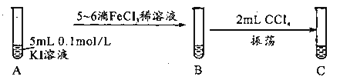
①振荡静置后C中观察到的现象是_______________________;为证明该反应存在一定限度,还应补做实验为:取C中分液后的上层溶液,然后______________(写出实验操作和现象)。
②测定上述KI溶液的浓度,进行以下操作:
I用移液管移取20.00 mL KI溶液至锥形瓶中,加入适量稀硫酸酸化,再加入足量H2O2溶液,充分反应。
II小心加热除去过量的H2O2。
III用淀粉做指示剂,用c mol/L Na2S2O3标准溶液滴定,反应原理为:2Na2S2O3+I2=2NaI+Na2S4O6。
步骤II是否可省略?____________(答“可以”或“不可以”)
步骤III达到滴定终点的现象是___________________________。巳知I2浓度很高时,会与淀粉形成稳定的包合物不易解离,为避免引起实验误差,加指示剂的最佳时机是________。
(2)探究Mn2+对KMnO4酸性溶液与H2C2O4溶液反应速率的影响。
反应原理(化学方程式)为________;
仪器及药品:试管(两支)、0.01 mol/L KMnO4酸性溶液、0.1 mol/L H2C2O4溶液、一粒黄豆大的MnSO4固体;
实验方案:请仿照教材(或同教材)设计一个实验用表格,在行标题或列标题中注明试剂及观察或记录要点。______________
-
为探讨浓度对化学平衡的影响,某同学对可逆反应 “2Fe3++2I- 2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。
2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。
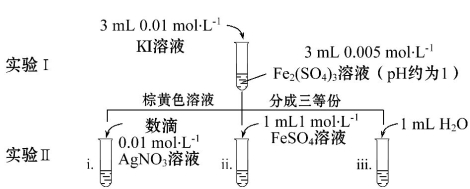
说明:0.005 mo l·L-1的Fe2(SO4)3溶液颜色接近于无色。
l·L-1的Fe2(SO4)3溶液颜色接近于无色。
(1)实验中要待实验Ⅰ溶液颜色不再改变时,才能进行实验Ⅱ,目的是 。
(2)实验Ⅱ中,ⅰ的现象是 ,该实验证明 。
(3)实验Ⅱ中,ⅲ的化学平衡向 移动(填“正反应方向”或“逆反应方向”);ⅲ的现象是溶液变浅,该现象 (填“能”或“不能”)说明化学平衡发生移动。如果前一空填“能”,则下一空不填;如果前一空填“不能”,则ⅲ的目的是 。
(4)实验Ⅱ中,ⅱ的现象是 ,即能证明增大生成物浓度化学平衡发生了逆向移动。
(5)除了上图中的方法外,若要使该可逆反应的化学平衡逆向移动,还可以采用的方法有 。
-
在水溶液中Fe3+和I-存在可逆反应:2Fe3++2I- 2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
A. 反应的平衡常数K=
B. 该可逆反应只能在酸性条件下存在
C. 加入AgNO3,平衡右移,溶液黄色变浅
D. 加入CCl4,平衡右移,水溶液层黄色变浅
-
Fe3+在I-在水溶液中的反应如下:2I-+2Fe3+═2Fe2++I2(水溶液).正向反应速率和I-、Fe3+的浓度关系为v=k[I-]m[Fe3+]n(k为常数)
| [I-] | [Fe3+] | v |
| (1) | 0.20 | 0.80 | 0.032k |
| (2) | 0.60 | 0.40 | 0.144k |
| (3) | 0.80 | 0.20 | 0.128k |
在v=k[I-]m[Fe3+]n中,m、n的值为( )
A.m=1,n=1
B.m=1,n=2
C.m=2,n=1
D.m=2,n=2
-
Fe3+和I-在水溶液中的反应为:2I-+2Fe3+ 2Fe2++I2(水溶液)。
2Fe2++I2(水溶液)。
该反应的平衡常数K的表达式为K= 。当上述反应达到平衡状态后,加入CCl4萃取I2,且温度不变,上述平衡 移动(填“向右”“向左”或“不”)。








