-
化学与社会、科学、技术、环境密切相关。下列说法正确的是( )
A.医用防护口罩中使用的聚丙烯熔喷布,其生产原料来自石油裂解
B.水泥、玻璃、青花瓷、水晶、玛瑙、分子筛都属于硅酸盐工业产品
C.人造刚玉熔点很高,可用作高级耐火材料,其主要成分是二氧化硅
D.通入过量的空气,可以使燃料充分燃烧,同时提高热量的利用率
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.CH3CH(OH)CH(CH3)CH3的系统命名为2—羟基—3—甲基丁烷
B.用电子式表示二氧化碳的形成过程:
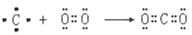
C.聚氯乙烯的链节:—CH2—CHCl—
D.甲醇和氧气设计成燃料电池,两极均以石墨为电极,K2CO3溶液为电解质,则负极电极反应式为:CH3OH+8OH--6e-=CO
+6H2O
难度: 中等查看答案及解析
-
下列实验操作中选用的部分仪器,正确的是( )
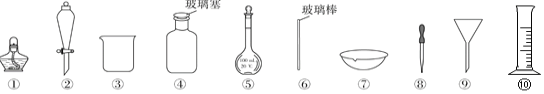
A.盛放NaOH溶液,选用④
B.从食盐水中获得食盐,选用①、⑥、⑦
C.分离I2的四氯化碳溶液,选用②、③
D.配制一定质量分数NaCl溶液,选用③、⑤、⑥和⑧
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次 增大。在如图所示的物质转化关系中,p、q、 m.n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol • L -1 ,t 溶液与 0.1 mol • L -1 u 溶液的pH均为1。下列说法不正确的是
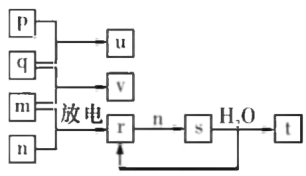
A.Y、W的兹高价氧化物对应的水化物均为强酸
B.元索的非金属性:Z>Y>X;原子半径:X<Z<Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.的电子式可表示为
难度: 简单查看答案及解析
-
2020年2月,科学家报道了利用磁性纳米Fe3O4颗粒除去水体草甘膦污染物的方法,其原理如图所示:(Fe3O4颗粒在水中表面会带—OH,在水体pH≈4时除污效果最好)。下列说法不正确的是( )
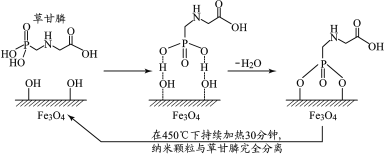
A.草甘膦既可以和盐酸反应,又可以和氢氧化钠溶液反应
B.Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂
C.Fe3O4纳米颗粒粒径越小、溶液中c(OH−)越大除污效果越好
D.处理完成后,Fe3O4纳米颗粒可利用磁铁回收,经加热活化重复使用
难度: 中等查看答案及解析
-
“太阳水”电池装置如图所示,该电池由三个电极组成,其中 a 为TiO2电极,b 为Pt 电极,c 为 WO3 电极,电解质溶液为 pH=3 的 Li2SO4-H2SO4 溶液。锂离子交换膜将电池分为 A、B 两个区,A 区与大气相通,B 区为封闭体系并有 N2 保护。下列关于该电池的说法错误的是
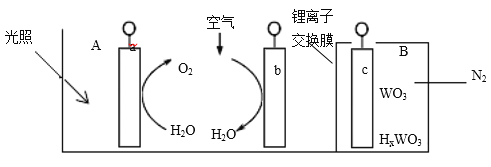
A.若用导线连接a、c,则 a 为负极,该电极附近 pH 减小
B.若用导线连接 a、c,则 c 电极的电极反应式为HxWO3-xe-=WO3+ xH+
C.若用导线连接 b、c,b 电极的电极反应式为 O2+4H++4e-=2H2O
D.利用该装置,可实现太阳能向电能转化
难度: 困难查看答案及解析
-
用亚硫酸盐(X)吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数(δ)与溶液pH的变化关系如图所示。下列说法中不正确的是( )
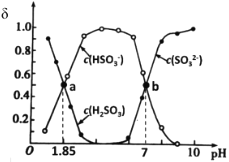
A.若X为(NH4)2SO3,图中b点溶液中n(HSO
)∶n(NH
)=1∶3
B.若X为Na2SO3,当吸收液呈中性时:lgc(HSO
)-lgc(H2SO3)=5.15
C.若X为(NH4)2SO3,(NH4)2SO3溶液呈碱性,说明水解程度:SO
>NH
D.若X为Na2SO3,当吸收液pH=1.85时:c(Na+)=2c(HSO
)+c(SO
)
难度: 困难查看答案及解析
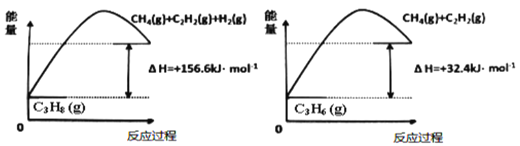
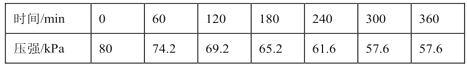
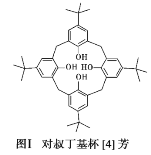
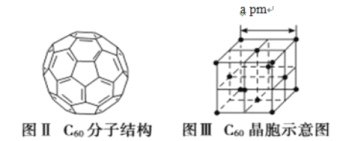
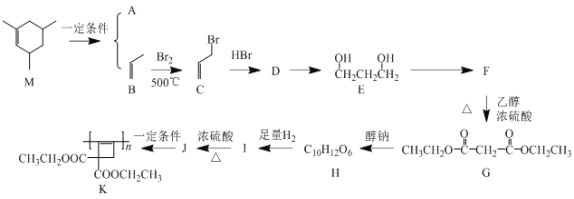
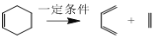
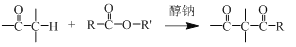 +HO—R’
+HO—R’