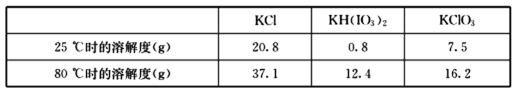
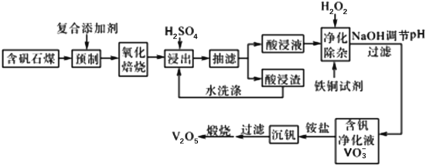
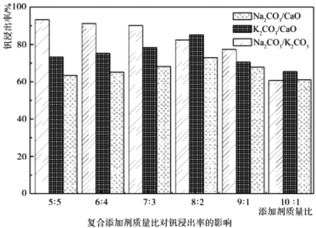
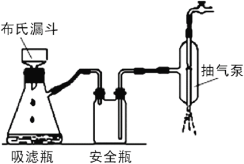
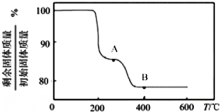
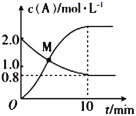
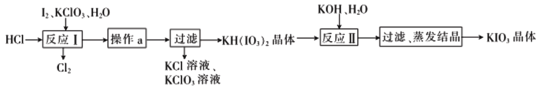-
中华诗词中蕴含着许多化学知识。下列关于诗词的分析错误的是( )
A.“九秋风露越窑开,夺得千峰翠色来”中的“翠色”来自氧化铜
B.“嫘祖栽桑蚕吐丝,抽丝织作绣神奇”中的“丝”不耐酸碱
C.“手如柔荑,肤如凝脂”中的“脂”能够水解
D.“墨滴无声人水惊,如烟袅袅幻形生”中的“墨滴”具有胶体的性质
难度: 简单查看答案及解析
-
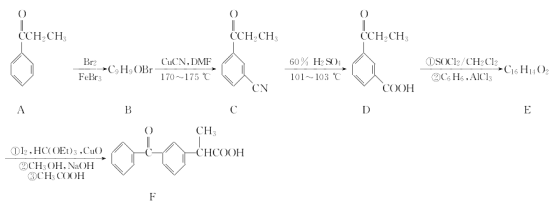
Y是合成药物查尔酮类抑制剂的中间体,可由X在一定条件下反应制得。下列叙述正确的是
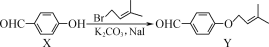
A.Y的分子式为C12H16O2
B.可用FeCl3溶液鉴别X和Y
C.Y能使酸性高锰酸钾溶液褪色可证明其分子中含有碳碳双键
D.1 mol X与4 mol H2完全加成所得产物分子中含2个手性碳原子
难度: 中等查看答案及解析
-
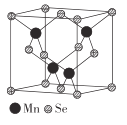
科学家研制出了一种漂白效率极高的新型漂白剂(结构如图所示),其中W、X、Y、Z均为短周期元素且原子序数依次增大。常温下,0.1mol/LZ的氢化物的水溶液pH=1,且Z与Y位于不同周期。下列叙述正确的是( )
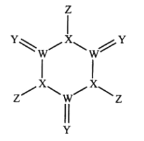
A.原子半径:Z>Y>X>W
B.氢化物的沸点:Y>X>Z>W
C.X的氧化物的水化物是强酸
D.Y的某种单质具有杀菌消毒作用
难度: 中等查看答案及解析
-
以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )
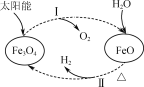
A. 过程Ⅰ中的能量转化形式是太阳能→化学能
B. 过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C. 过程Ⅱ的化学方程式为3FeO+H2O
Fe3O4+H2↑
D. 铁氧化合物循环制H2具有节约能源、产物易分离等优点
难度: 中等查看答案及解析
-
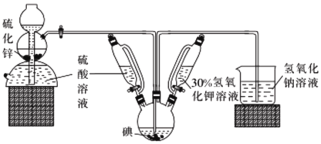
下列实验操作能达到实验目的的是
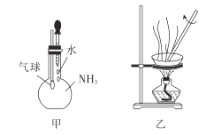
A.用装置甲验证NH3极易溶于水
B.用50mL量筒量取10mol·L-1硫酸2mL,加水稀释至20mL,配制1mol·L-1稀硫酸
C.用pH试纸测量氯水的pH
D.用装置乙制取无水FeCl3
难度: 简单查看答案及解析
-
常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是
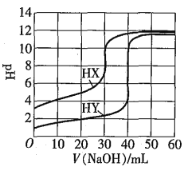
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:
难度: 中等查看答案及解析
-
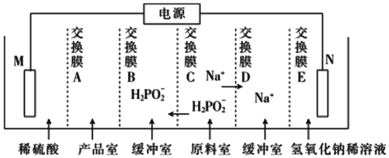
复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是
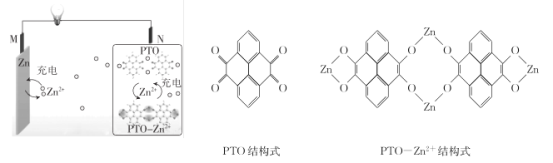
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.放电时,每生成1 mol PTO- Zn2+ ,M极溶解Zn的质量为260 g
D.充电时,N极的电极反应式为2PTO+8e- +4Zn2+=PTO- Zn2+
难度: 中等查看答案及解析