-
化学消毒剂在抗击新型冠状病毒肺炎的战役中发挥了重要作用,下列说法错误的是
A.84消毒液与洁厕灵不能混合使用
B.无机含氯消毒剂消毒效果较好,在空气中均比较稳定
C.稀碘伏溶液可用于皮肤消毒
D.来苏水为医院常用消毒剂,其有效成分为酚类
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A.CH3CH(CH3)CH2CH2OH名称为:3-甲基丁醇
B.
一氯代物有5种
C.标准状况下,22.4L丙烯中含有7NA个σ键,NA个π键
D.
能发生消去反应,其产物有2种
难度: 中等查看答案及解析
-
“冰面为什么滑?”,这与冰层表面的结构有关(如图)。下列有关说法错误的是

A.由于氢键的存在,水分子的稳定性好,高温下也很难分解
B.第一层固态冰中,水分子间通过氢键形成空间网状结构
C.第二层“准液体”中,水分子间形成氢键的机会比固态冰中少
D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性的水分子”,使冰面变滑
难度: 中等查看答案及解析
-
依据下表提供的主要玻璃仪器(夹持装置已略),可以实现实验目的的是
选项
实验目的
主要仪器
A
用溴水和CCl4除去NaBr溶液中的少量NaI
烧杯、玻璃棒、胶头滴管、分液漏斗
B
准确量取一定体积K2Cr2O7标准溶液
碱式滴定管、烧杯、锥形瓶
C
用新制Cu(OH)2悬浊液鉴别葡萄糖和蔗糖
试管、胶头滴管
D
实验室制乙烯
圆底烧瓶、导管、酒精灯
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
有机物M和N的结构简式如图所示,下列说法正确的是

A.M和N都能与银氨溶液反应
B.等物质的量的M和N完全燃烧耗氧量不同
C.N分子中所有碳原子可能处于同一平面上
D.M和N中均含有1个手性碳原子
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期主族元素,只有W为金属元素。甲、乙、丙分别为X、Z、W三种元素所对应的单质。A、B、C、D均为由X、Y、Z三种元素组成的化合物,化合物B的稀溶液常用于保存动物标本。它们的转化关系如图所示。下列说法错误的是
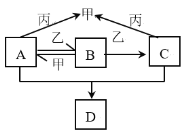
A.X与Z可组成非极性分子
B.原子半径大小关系是:r(X)<r(Z)<r(Y)<r(W)
C.四种化合物中B的沸点最低
D.四种化合物中Y原子的杂化方式有2种
难度: 困难查看答案及解析
-
下列实验能达到目的且过程正确的是
编号
实验目的
实验过程
A
检验某红棕色气体是否为溴蒸气
将气体通入淀粉KI溶液中,观察溶液是否变蓝
B
配制0.10mol·L-1的Na2CO3溶液
称取5.3g固体Na2CO3于烧杯中,加入少量蒸馏水溶解,冷却后转移至500mL容量瓶中定容
C
观察Mg条与CO2气体反应现象
取一小段除去表面氧化膜的Mg条,用坩埚钳夹持点燃,迅速投入到只充满CO2气体的集气瓶中
D
证明难溶物存在沉淀溶解平衡
往黄色固体难溶物PbI2中加水,振荡,静置。取上层清液,然后加入NaI固体,产生黄色沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
我国科研人员发现,在钙钛矿活性层中引入稀土Eu3+/Eu2+离子对,通过循环反应可消除零价铅和零价碘缺陷,大幅提高钙钛矿电池的使用寿命,其原理如图。下列说法正确的是
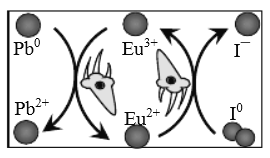
A.Eu3+/Eu2+离子对在反应过程中不断损耗,需定时补充
B.消除零价碘的过程中,Eu3+/Eu2+离子对发生还原反应
C.消除零价铅的反应为:2Eu3++Pb0=2Eu2++Pb2+
D.整个过程实质上将电子从I0转移给Pb0
难度: 简单查看答案及解析
-
某同学做“FeSO4被HNO3氧化”的实验,发现溶液变深棕色。猜想可能是生成的NO2或NO与Fe2+或Fe3+反应,使溶液变为深棕色,设计下列装置探究。下列说法错误的是
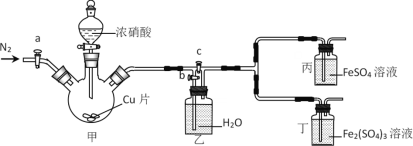
A.先检查装置气密性,加入药品后,关闭c,打开a和b,再通入一段时间N2
B.关闭a、c,打开b及分液漏斗活塞,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO与Fe2+反应
C.甲中反应一段时间后,更新丙、丁中试剂,关闭a和b,打开c,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO2也可与Fe2+反应
D.该实验的缺陷是缺少尾气吸收装置
难度: 中等查看答案及解析
-
为防治雾霾,设计如下流程吸收工业尾气SO2和NO,同时获得连二亚硫酸钠(Na2S2O4,其结晶水合物又称保险粉)和NH4NO3产品,以变“废”为宝。
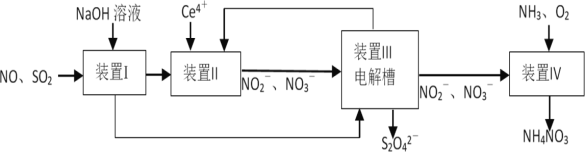
下列说法错误的是
A.S2O
中既存在非极性键又存在极性键
B.装置I的作用是吸收SO2,装置II的作用是吸收NO
C.保险粉可通过装置Ⅲ中阳极产物制备,Ce4+从阴极口流出回到装置II循环使用
D.氧化装置IV中1L 2mol•L-1NO
,至少需要标准状况下22.4LO2
难度: 困难查看答案及解析
-
目前可采用“双极膜组”电渗析法淡化海水,同时获得副产品A和B。其模拟工作原理如图所示。M、N为离子交换膜,在直流电作用下,双极阴阳膜(BP)复合层间的H2O解离成H+和OH-,作为H+和OH-的离子源。下列说法正确的是
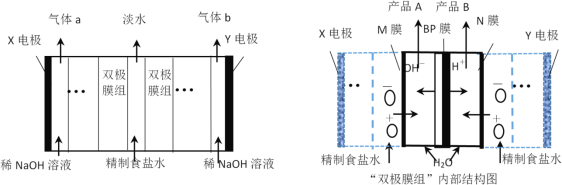
A.Y电极为阳极,电极反应式为2Cl――2e-=Cl2↑
B.M为阳离子交换膜,N为阴离子交换膜,BP膜作用是选择性通过Cl-和Na+
C.电路中每生成0.25 mol气体a,理论上获得副产品A和B各1 mol
D.“双极膜组”电渗析法也可应用于从盐溶液(MX)制备相应的酸(HX)和碱(MOH)
难度: 困难查看答案及解析
-
我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是
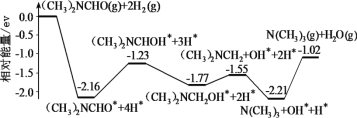
A.该历程中最小能垒的化学方程式为 (CH3)2NCH2OH*=(CH3)2NCH2+OH*
B.该历程中最大能垒(活化能)为2.16eV
C.该反应的热化学方程式为(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02ev•mol-1
D.增大压强或升高温度均能加快反应速率,并增大DMF平衡转化率
难度: 中等查看答案及解析

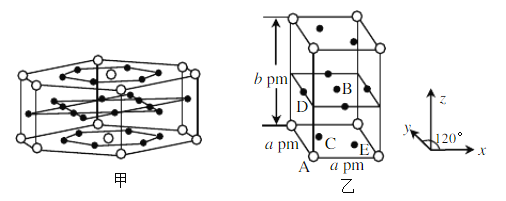
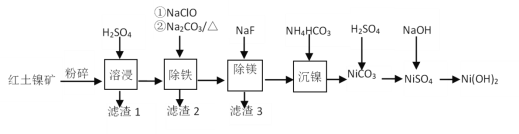
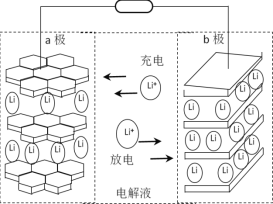
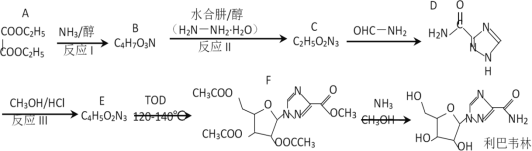
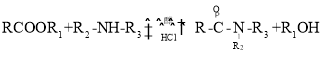 (R代表H或其他基团)
(R代表H或其他基团)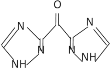 的合成路线_____________(无机试剂任选)。
的合成路线_____________(无机试剂任选)。