-
有共价键的离子化合物是( )
A.SiO2 B.Ba(OH)2 C.MgCl2 D.H2O2
难度: 简单查看答案及解析
-
实验室制备摩尔盐,不必用到的仪器是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列属于有机物,又是电解质的是( )
A.葡萄糖 B.乙醛 C.氯化钠 D.苯酚
难度: 简单查看答案及解析
-
工业上冶炼钛的反应如下:TiCl4+2Mg
Ti+2MgCl2。下列有关该反应的说法正确的是( )
A.TiCl4是还原剂 B.Mg被氧化 C.TiCl4发生氧化反应 D.Mg得到电子
难度: 简单查看答案及解析
-
下列化学物质的名称正确的是( )
A.苯酚:石炭酸
B.SiO2:刚玉
C.(NH4)2CO3:碳铵
D.(CH3)2C(CH2CH3)CH2CH(CH3)CH2CH3:3,5,5—三甲基庚烷
难度: 简单查看答案及解析
-
下列化学用语表达正确的是( )
A.硫原子结构示意图:
B.KF的电子式:
C.甲酸甲酯的结构简式:C2H4O2
D.氯化钙的分子式:CaCl2
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是
A.H2与D2互为同素异形体
B.符合CnH2n+2且n不同的烃一定属于同系物
C.CH2Cl2有2种同分异构体
D.碳元素有多种核素,其中l3C可用于考古断代
难度: 中等查看答案及解析
-
下列叙述正确的是
A.铜与过量的硫粉共热产物是Cu2S
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.我国华为Al芯片已跻身于全球Al芯片榜单前列,该芯片的主要材料是二氧化硅
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
难度: 中等查看答案及解析
-
下列物质的制备,不符合工业生产实际的是( )
A.工业上用电解熔融氯化镁制备单质镁
B.工业上用电解饱和食盐水制备氯气
C.工业上用二氧化硅在高温下与焦炭反应制得高纯硅
D.工业上炼铁时,常用石灰石除去铁矿石中的二氧化硅
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.糖类化合物中H、O原子个数比一定为2∶1
B.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
C.乙烯和聚氯乙烯都能使溴的四氯化碳溶液褪色
D.石油的裂解可使石油分馏产物中的长链烃断裂成各种气态短链烃
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.准确量取25.00mL的液体可选用移液管、量筒或滴定管等量具
B.实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗
C.用分液漏斗分液时要经过振荡、放气、静置后,从上口倒出上层液体,再打开旋塞,将下层液体从下口放出
D.在中和热测定实验中,盐酸和NaOH溶液的总质量mg,反应前后体系温度变化为t,反应液的比热容为cJ·g-1·℃,则生成1mol水放出的热量为c×m×t×10-3kJ
难度: 简单查看答案及解析
-
下列关于铝及其化合物的叙述正确的是( )
A. 氧化铝坩埚可用于熔融NaOH实验
B. 铝与Fe2O3发生铝热反应,反应后固体物质增重
C. 氧化铝熔点很高,可作耐火材料
D. 明矾用作净水剂,可以除去废水中的铜离子
难度: 中等查看答案及解析
-
不能正确表示下列变化的离子方程式是
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2
+CO2+H2O=2
+CO32—
D.醋酸钠水【解析】
CH3COO−+H2OCH3COOH+OH−
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在
B.用酸性KMnO4溶液直接检验乙醇与浓硫酸反应是否得到乙烯
C.用C8H18萃取溴水中的溴,可观察到溶液分层,上层为橙红色,下层接近无色
D.热的苯酚浓溶液放入冷水中冷却,溶液变浑浊,此时发生了化学反应
难度: 中等查看答案及解析
-
吗替麦考酚酯主要用于预防同种异体的器官排斥反应,其结构简式如下图所示。
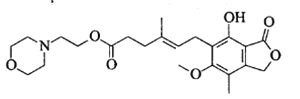
下列说法正确的是
A. 吗替麦考酚酯的分子式为C23H30O7N
B. 吗替麦考酚酯可发生加成、取代、消去反应
C. 吗替麦考酚酯分子中所有碳原子一定处于同一平面
D. 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.同一主族中,随着核电荷数的增加,元素的原子半径逐渐增大
B.同一周期中,ⅡA与ⅢA族元素原子的核电荷数可能相差11
C.原子核外电子排布,先排满K层再排L层、先排满L层再排M层
D.同一原子中,在离核较近的区域运动的电子能量较高
难度: 简单查看答案及解析
-
关于常温下pH=2的H3PO4溶液,下列说法正确的是( )
A.c(H3PO4)=
mol/L
B.c(H+)=c(H2PO
)+2c(HPO
)+3c(PO
)+c(OH-)
C.加水稀释使电离度增大,溶液pH减小
D.加入NaH2PO4固体,溶液酸性增强
难度: 简单查看答案及解析
-
碳呼吸电池被誉为改变世界的创新技术,设想用碳呼吸电池为钠硫电池充电的装置如下图所示:下列说法不正确的是
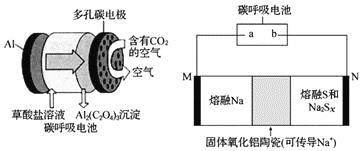
A.b极是多孔碳电极
B.充电时,
通过固体氧化铝陶瓷向M极移动
C.随着反应的进行,碳呼吸电池中
浓度不断减小
D.充电过程中碳呼吸电池每消耗
,N极上可生成
单质
难度: 中等查看答案及解析
-
25℃,向40mL0.05mol/L的FeCl3溶液中加入10mL0.15mol/L的KSCN溶液,发生反应:Fe3++3SCN-
Fe(SCN)3,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示。(盐类的水解影响忽略不计)下列说法正确的是( )
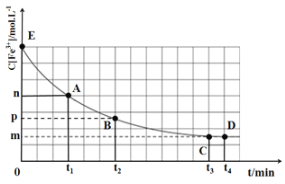
A.在该反应过程中,A点的正反应速率小于B点的逆反应速率
B.E点对应的坐标为(0,0.05)
C.该反应的平衡常数K=
D.t4时向溶液中加入50mL0.1mol/LKCl溶液,平衡不移动
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.足量的镁与浓硫酸充分反应,放出2.24LSO2和H2混合气体时,转移电子数为0.2NA
B.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA
C.硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为NA
D.含有NA个Fe(OH)3胶粒的氢氧化铁胶体中,铁元素的质量为56g
难度: 中等查看答案及解析
-
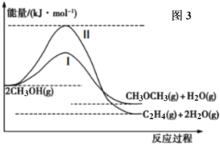
在容积为2L的刚性密闭容器中加入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g)。在其他条件不变的情况下,温度对反应的影响如图所示(注:T1、T2均大于300℃)。下列说法正确的是( )
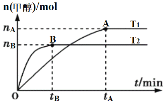
A.该反应在T1时的平衡常数比在T2时的小
B.处于A点的反应体系从T1变到T2,达到平衡时
减小
C.T2时,反应达到平衡时生成甲醇的反应速率v(CH3OH)=
mol·L-1·min-1
D.T1时,若反应达到平衡后CO2的转化率为x,则容器内的压强与起始压强之比为(2-x)∶2
难度: 中等查看答案及解析
-
某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。下列说法不正确的是( )
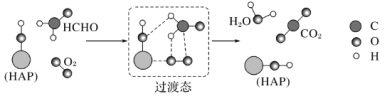
A.HAP能提高HCHO与O2的反应速率
B.HCHO在反应过程中,有C—H键发生断裂
C.根据图示信息,CO2分子中的氧原子全部来自O2
D.该反应可表示为:HCHO+O2
CO2+H2O
难度: 中等查看答案及解析
-
常温下,一元弱碱甲胺(CH3NH2)的电离常数Kb≈4.0×10-4,lg5≈0.7。电解质溶液的电导率与离子浓度有关,电导率越大,溶液的导电能力越强。常温下,用0.02mol·L-1盐酸分别滴定20.00mL浓度均为0.02mol·L-1的NaOH溶液和CH3NH2溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列推断正确的是( )
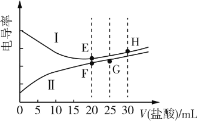
A.曲线Ⅰ代表NaOH的滴定曲线,H点对应的溶液中不存在电离平衡
B.G点对应的溶液中:c(Cl-)>c(H+)>c(CH3NH
)>c(OH-)
C.常温下,E、F点对应的溶液中水电离的c(H+)水·c(OH-)水=1.0×10-14
D.常温下,F点对应的溶液的pH≈6.3
难度: 中等查看答案及解析
-
一定条件下,Fe吸收CO生成配合物Fe(CO)5。常温下,Fe(CO)5是一种黄色液体,易溶于汽油、苯等多数有机溶剂。下列说法一定错误的是( )
A.Fe(CO)5为分子晶体
B.Fe(CO)5难溶于水
C.Fe(CO)5属于含氧盐
D.Fe吸收CO生成Fe(CO)5的变化是化学变化
难度: 简单查看答案及解析
-
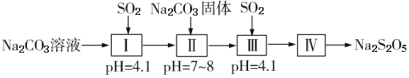
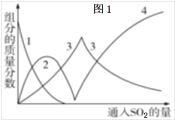
某固体混合物X可能由Ba(OH)2、NaOH、Na2CO3、KCl、K2SO4中的几种物质混合而成。取适量样品进行如下实验(假设各反应物都充分反应),得到实验现象和实验数据:
①将X加入水中,得到不溶物Y和溶液Z;
②取不溶物Y加入足量稀硫酸,沉淀质量增加;
③向Z中滴加氯化铵溶液,加热,产生能使红色石蕊试纸变蓝的气体并得到溶液W;
④向溶液W中滴加硝酸酸化硝酸银溶液,产生白色沉淀。
下列说法正确的是( )
A.不溶物Y中含BaCO3和BaSO4
B.固体混合物X中一定有Ba(OH)2、Na2CO3、K2SO4
C.根据上述实验现象无法确定固体混合物X中是否有NaOH
D.用铂丝蘸取溶液Z在酒精灯火焰上灼烧,通过蓝色钴玻璃观察焰色,即可判断X中有无KCl
难度: 中等查看答案及解析
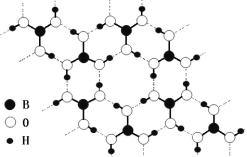
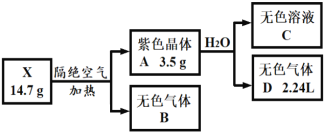
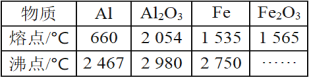
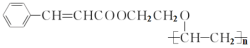 。由A、X为原料,按如下流程可以合成甲,其中试剂I可由一定条件下炔烃与水反应制得,试剂X的质谱图显示最大的峰值为106。
。由A、X为原料,按如下流程可以合成甲,其中试剂I可由一定条件下炔烃与水反应制得,试剂X的质谱图显示最大的峰值为106。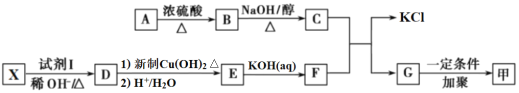
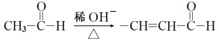 +H2O
+H2O