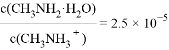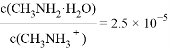-
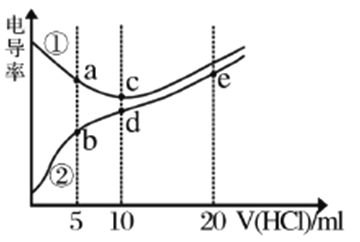
常温下,一元弱碱甲胺(CH3NH2)的电离常数Kb≈4.0×10-4,lg5≈0.7。电解质溶液的电导率与离子浓度有关,电导率越大,溶液的导电能力越强。常温下,用0.02mol·L-1盐酸分别滴定20.00mL浓度均为0.02mol·L-1的NaOH溶液和CH3NH2溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列推断正确的是( )
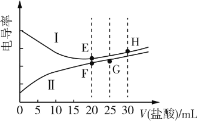
A.曲线Ⅰ代表NaOH的滴定曲线,H点对应的溶液中不存在电离平衡
B.G点对应的溶液中:c(Cl-)>c(H+)>c(CH3NH )>c(OH-)
)>c(OH-)
C.常温下,E、F点对应的溶液中水电离的c(H+)水·c(OH-)水=1.0×10-14
D.常温下,F点对应的溶液的pH≈6.3
-
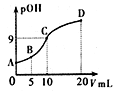
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
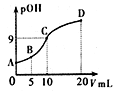
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-
B. A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C. C点所在溶液中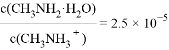
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
-
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-
B. A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C. C点所在溶液中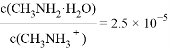
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
-
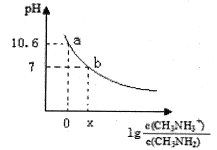
甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2O CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
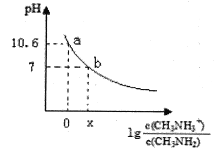
A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C. b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-)
D. V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
-
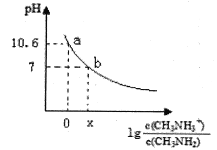
甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2O CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
A.b点对应加入盐酸的体积V<20.00mL
B.常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C.b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-)
D.V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
-
甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2O CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
A.b点对应加入盐酸的体积V<20.00mL
B.常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C.b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-)
D.V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
-
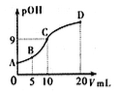
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定10mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-
B. A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C. C点所在溶液中 =2.5×10-5
=2.5×10-5
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
-
电解质溶液电导率越大导电能力越强。常温下用0.100 mol/L盐酸分别滴定10.00mL浓度均为0.100mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb=1.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
A. a、d、e三点的溶液中,水的电离程度最大的是d点
B. 溶液温度c点高于d点
C. b点溶液中:c[(CH3)2NH2+] +c[(CH3)2NH·H2O]=2c(Cl-)
D. d点溶液中: c(H+) + c[(CH3)2NH·H2O]=c(OH-)
-
电解质溶液导电能力越强,电导率越大。常温下用0.1000 mol/L 盐酸分别滴定10.00 mL浓度均为0.1000 mol/L 的NaOH溶液和二甲胺[(CH3)2NH]溶液( 二甲胺在水中电离与氨相似,已知在常温下Kb[(CH3)2NH·H2O]=1.6×10-4),利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
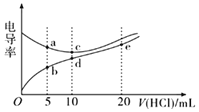
A.盐酸滴定二甲胺实验中选择酚酞做指示剂比选甲基橙误差更小
B.d点溶液中:c(H+)<c(OH-)+c[(CH3)2NH2+]
C.a 点溶液与d点的溶液混合后的溶液中:c[(CH3)2NH2+]<c[(CH3)2NH·H2O]
D.b、c、e三点的溶液中,水的电离程度最大的是e点
-
电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液 (二甲胺在水中的电离与氨相似,在常温下Kb[(CH3)2NH·H2O]=1.6×10-4 )。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
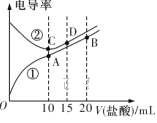
A. D点溶液中:2c(Na+)=3c(Cl-)
B. A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C. 曲线②代表滴定二甲胺溶液的曲线
D. 在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点

)>c(OH-)