-
下列关于强、弱电解质的叙述中正确的是( )
A. 强电解质都是离子化合物,弱电解质都是共价化合物
B. 强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C. 强电解质熔化时都完全电离,弱电解质在水溶液中部分电离
D. 强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱
难度: 简单查看答案及解析
-
某同学用0.1 mol/L 的盐酸滴定20.00 mL NaOH溶液,测定其浓度。下列操作正确的是
A. 需用NaOH溶液润洗锥形瓶
B. 用量筒量取20.00 mL NaOH溶液
C. 滴定前,使酸式滴定管尖嘴部分充满盐酸
D. 充分反应后,滴入酚酞溶液,观察是否到达滴定终点
难度: 简单查看答案及解析
-
根据生活经验,判断下列物质或其水溶液按pH的一定顺序依次排列正确的是( )
A.“84”消毒液、洁厕灵、食盐、可乐
B.可乐、洁厕灵、食盐、“84”消毒液
C.洁厕灵、可乐、食盐、“84”消毒液
D.洁厕灵、食盐、可乐、“84”消毒液
难度: 简单查看答案及解析
-
下图表示的是某物质所发生的
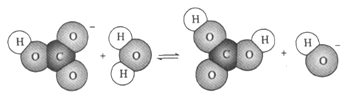
A.置换反应 B.水解反应 C.中和反应 D.电离过程
难度: 简单查看答案及解析
-
下列属于放热反应的是( )
A.电解水反应
B.煅烧石灰石
C.铝和硫酸铜溶液反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应
难度: 简单查看答案及解析
-
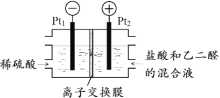
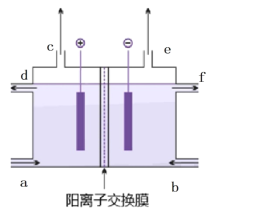
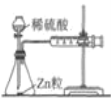
原电池是化学电源的雏形。若保持如图所示原电池的电池反应不变,下列说法正确的是( )
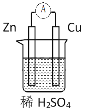
A.稀H2SO4可以换成酒精
B.稀H2SO4可以换成浓硫酸
C.Zn可以换成Fe
D.Cu可以换成石墨
难度: 中等查看答案及解析
-
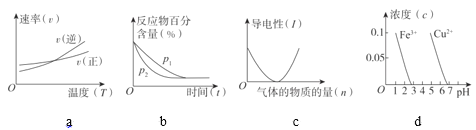
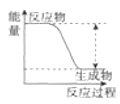
已知:2SO2(g)+O2(g)
2SO3(g) ΔH=xkJ·mol–1,不同条件下反应过程能量变化如图所示。下列说法中不正确的是( )
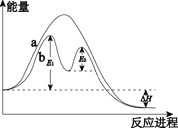
A.反应的ΔH<0
B.过程b使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.过程b发生两步反应,第一步为吸热反应
难度: 简单查看答案及解析
-
可逆反应N2(g)+3H2(g)
2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v (N2)正=v (H2)正
B.v (N2)正=v (NH3)逆
C.v (N2)正=3v (H2)逆
D.2v (H2)正=3v (NH3)逆
难度: 简单查看答案及解析
-
中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键
H2O中H—O键
O2中O=O 键
H2中H—H键
H2O2中O—O键
H2O2中O—H键
键能kJ/mol
463
496
436
138
463
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
难度: 中等查看答案及解析
-
一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g)
C(g)+D(s)。达到平衡时,测得压强为原压强的5/6。则A的转化率为
A. 25% B. 40% C. 50% D. 75%
难度: 中等查看答案及解析
-
能源是当今社会发展的三大支柱之一。有专家提出:如果能够利用太阳能使燃料燃烧产物,如 CO2、H2O、N2 等重新组合(如图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为( )
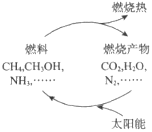
A.化学能 B.热能 C.生物能 D.电能
难度: 简单查看答案及解析
-
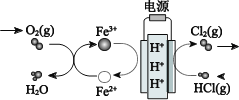
铜是人类最早发现和使用的金属之一,铜及其合金的用途广泛。粗铜中含有少量铁、锌、银、金等杂质,工业上可用电解法精炼粗铜制得纯铜,下列说法正确的是
A. 精铜做阳极,粗铜做阴极
B. 可用AgNO3溶液做电解质溶液
C. 电解时,阴极反应为Cu – 2e- === Cu2+
D. 电解后,可用阳极泥来提炼金、银
难度: 中等查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是( )
A.CaCO3溶于稀盐酸
B.镁条与氯化铵溶液反应生成氢气
C.升高温度,水的离子积增大
D.加入少量CuSO4可增大锌与稀硫酸反应的速率
难度: 简单查看答案及解析
-
关于
溶液,下列判断不正确的是 ( )
A. 粒子种类与
溶液相同
B. 升高温度,
增大
C. 加入
溶液,
减小
D.
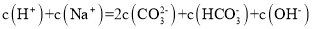
难度: 中等查看答案及解析
-
下列各组离子,在所给条件下可能大量共存的是( )
A.25℃,在pH=0的溶液中:Fe2+、Cu2+、Cl-、NO
B.在FeCl3溶液中:Na+、OH-、SO
、NO
C.25℃,在水电离出的c(H+)=10-12mol•L-1的溶液中:NH
、Cl-、HCO
、NO
D.能使酚酞显红色的溶液中:K+、Cl-、NO
、SO
难度: 中等查看答案及解析
-
常温下,将pH=11的NaOH溶液与pH=3的某酸HA溶液等体积混合后,下列关系式可能成立的是( )
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(A-)>c(Na+)>c(H+)>c(OH-)
C.c(Na+)=c(A-)+c(HA)
D.c(H+)=c(A-)+c(OH-)
难度: 中等查看答案及解析
-
下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是( )
A
B
C
D
反应装置或图象
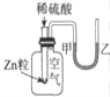
实验现象或图象信息
温度计的水银柱上升
反应物总能量大于生成物总能量
反应开始后,针筒活塞向右移动
反应开始后,甲处液面低于乙处液面
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
常温,下列实验操作及现象与推论不相符的是( )
选项
操作及现象
推论
A
用pH试纸测得0.1mol/LCH3COOH溶液pH约为3
CH3COOH是弱电解质
B
向某无色溶液中加入足量稀盐酸,产生无色无味气体;再将该气体通入澄清石灰水,产生白色浑浊
溶液中可能含有CO
或HCO
C
用pH计测定相同浓度的CH3COONa溶液和NaClO溶液的pH,前者的pH小于后者的
HClO的酸性弱于CH3COOH
D
向2mL1mol/LNaOH溶液中加入1mL0.1mol/LMgCl2溶液,产生白色沉淀;再加入1mL0.1mol/LFeCl3溶液,产生红褐色沉淀
Mg(OH)2沉淀转化为Fe(OH)3沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
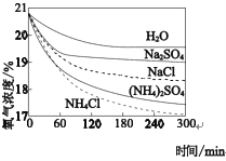
某研究性学习小组通过测量溶液的电导率(电导率越大,说明溶液的导电能力越强)探究沉淀溶解平衡,各物质的电导率数据如下:
①
②
③
④
⑤
⑥
⑦
物质
固体
饱和溶液
饱和溶液
NaCl溶液
溶液
饱和溶液
电导率
0
7
37
389
1989
1138
13
下列分析不正确的是
A.
固体中不存在自由移动的离子
B. 与①、②对比,可说明③中
发生了电离
C. ⑤、⑥等体积混合后过滤,推测滤液的电导率一定大于13
D. 将①中固体加入④中,发生反应:
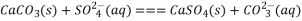
难度: 中等查看答案及解析
-
已知
和
可以相互转化
。现将一定量
和
的混合气体通入体积为1L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是
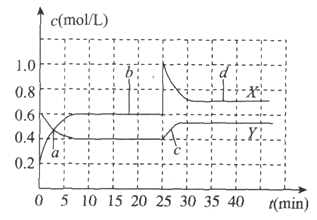
A. 反应进行至25min时,曲线发生变化的原因是加入0.4mol
B. a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C. 图中共有两条曲线X和Y,其中曲线X表示
浓度随时间的变化
D. 若要达到与d相同的状态,在25min时还可以采取的措施是适当缩小容器体积
难度: 中等查看答案及解析