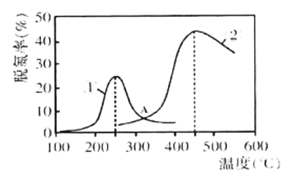
-
下列说法正确的是
A. 氯水应保存在棕色广口瓶中并置于阴凉处
B. 用玻璃棒蘸醋酸溶液点在用水润湿的pH试纸上,测定该溶液pH
C. 焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后再进行实验
D. 用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装溶液润洗
难度: 中等查看答案及解析
-
有关硫及其化合物说法正确的是
A.有浓硫酸参与的反应都是氧化还原反应
B.硫在足量空气中燃烧生成大量SO3
C.SO2能使酸性高锰酸钾溶液褪色,体现了漂白性
D.二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加
难度: 简单查看答案及解析
-
下列说法正确的是
A. H2O分子之间的作用力大于H2S,故前者比后者稳定
B. NaHSO4属于含有共价键的离子化合物,加热融化时破坏了该物质中的离子键和共价键
C. 某晶体固态不导电,熔化时能导电,该晶体一定是离子晶体
D. CO2、N2都是所有原子最外层都满足8电子结构的共价化合物
难度: 中等查看答案及解析
-
下列物质因水解而显酸性的是
A.NaHSO3 B.HClO C.NH4Cl D.NaHCO3
难度: 简单查看答案及解析
-
下列属于物理变化的是
A. 煤的干馏 B. 粮食酿酒 C. 电解质导电过程 D. 石油的分馏
难度: 简单查看答案及解析
-
下列关于常见物质的用途说法不正确的是
A. 金属钠具有强还原性,可以用来置换TiCl4中的Ti
B. 二氧化氯具有强氧化性,可以用来漂白织物
C. 碳酸钡可用于肠胃X射线造影检查
D. 氢氧化铁胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,因而可以净水
难度: 简单查看答案及解析
-
下列转化必须要通过加氧化剂才能发生的是(不考虑电解)
A. NaHCO3→Na2CO3 B. KMnO4→O2 C. Kl→I2 D. Fe2O3→Fe
难度: 简单查看答案及解析
-
下列表示正确的是
A. 硫离子结构示意图
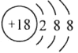 B. 甘氨酸的结构简式:H2NCH2COOH
B. 甘氨酸的结构简式:H2NCH2COOHC. 甲烷分子的比例模型:
D. NH4I的电子式:
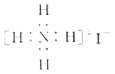
难度: 中等查看答案及解析
-
下列说法正确的是
A.
、
为不同的核素,化学性质也不同
B. 乙醇和乙醚互为同分异构体
C. CH3CH(CH3)2的名称叫2-甲基丙烷,也可以叫做异丁烷
D. CH2=CH2和CH2=CH-CH=CH2具有相同的官能团,互为同系物
难度: 中等查看答案及解析
-
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子原子序数之和为46。下列说法正确的是
X
Y
W
Z
T
A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 原子半径(r)大小比较r(Y)>r(X)
C. 物质WY2、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Y元素可形成化合物TY2
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.
溶液与稀硫酸反应:
B.向
溶液中通入过量的
气体:
C.
和
溶液按物质的量比1:2混合:
D.向
中通入过量的
:
难度: 中等查看答案及解析
-
一定条件下,在恒压绝热容器中发生反应:2SO2(g)+O2(g)
2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
A.达到化学平衡状态时,v正(O2)=2v逆(SO2)
B.容器内的压强不再变化说明反应达到化学平衡状态
C.加入0.2 mol SO2和0.1 mol O2,充分反应后放出热量19.7kJ
D.向容器中充入二氧化硫,正反应速率增大,逆反应速率减小
难度: 中等查看答案及解析
-
pH=1的两种酸溶液HA、HB各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
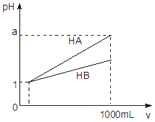
A.同浓度、同体积的HA、HB溶液分别加入过量的锌粒,产生的氢气体积后者大
B.pH相同的HA、HB溶液,物质的量浓度HA<HB
C.若1<a<4,则HA、HB都是弱酸
D.体积相同pH均为1的HA、HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 100g 46%的乙醇溶液中含4NA氧原子
B. 22.4LC2H4与C2H5OH的混合气体完全燃烧,消耗氧分子为2NA个
C. 标准状况下22.4LCl2与Fe充分反应转移电子数为3NA
D. 在1L 0.1mol·L-1醋酸钠溶液中阴离总数等于0.1NA
难度: 中等查看答案及解析
-
根据下图所示的过程中的能量变化情况,判断下列说法正确的是
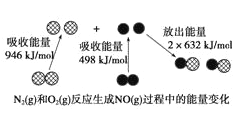
A.N2(g)转化为氮原子是一个放热过程
B.1mol N2和lmol O2的总能量比2molNO的总能量高
C.1个NO(g)分子中的化学键断裂时需要吸收632kJ能量
D.2NO(g)=N2(g)+O2(g)的反应热△H=-180 kJ/ mol
难度: 中等查看答案及解析
-
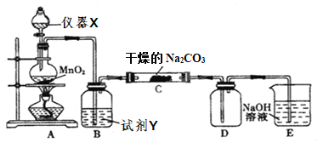
I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。i.SO2+4I-+4H+
S↓+2I2+2H2O ii.I2+2H2O+SO2
SO42- +4H++2I-
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号
Ⅰ
Ⅱ
Ⅲ
Ⅳ
试剂组成
0.4 mol·L-1 KI
a mol·L-1 KI
0.2 mol·L-1 H2SO4
0.2 mol·L-1 H2SO4
0.2 mol·L-1 KI
0.0002 mol I2
实验现象
溶液变黄,一段时间后出现浑浊
溶液变黄,出现浑浊较A快
无明显现象
溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快
下列说法不正确的是( )
A.水溶液中SO2歧化反应方程式为3SO2+2H2O
2H2SO4 +S↓
B.II是I的对比实验,则a=0.4
C.比较I、II、III,可得出的结论是:I−是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率
D.实验表明,SO2的歧化反应速率IV>I,原因是反应i比ii快;IV中由反应ii产生的H+使反应i加快
难度: 中等查看答案及解析
-
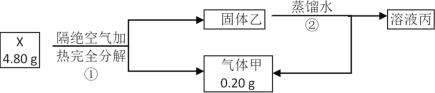
某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是
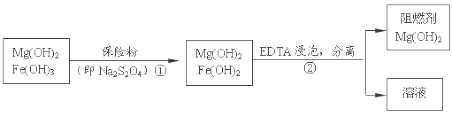
A.步骤②中分离操作的名称是过滤,Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热
B.步骤①中的反应式:3Fe(OH)3 +S2O42-+2OH- =3Fe(OH)2 +2SO42-+4H2O
C.步骤①中保险粉是作还原剂
D.从步骤② 中可知OH- 和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物
难度: 中等查看答案及解析
-
某溶液X中可能含有下列离子中的若干种:Iˉ、
、
、
、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
(1)向溶液X中加入足量的Ba(OH)2溶液,得到白色沉淀;
(2)将(1)的反应混合液过滤,将足量盐酸加入沉淀中,沉淀部分溶解且产生气体。
下列说法正确的是
A.(2)中产生的气体可能含有SO2
B.溶液X中一定存在
、
、Mg2+
C.溶液X中一定不存在Fe3+,可能存在Iˉ
D.无法确定溶液中是否含有Na+,需要做焰色反应才能确定
难度: 中等查看答案及解析