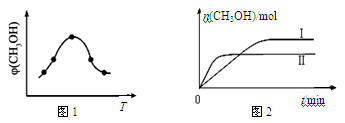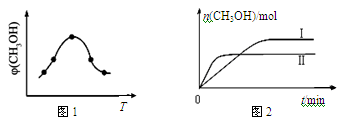-
研究NOx、CO2的吸收利用,对促进低碳社会的构建和环境的保护具有重要意义。
(1)已知C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=a kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=b kJ·mol-1
H2O(l)=H2O(g) △H=c kJ·mol-1
则C2H4(g)+6NO(g) 3N2(g)+2CO2(g)+2H2O(l)的反应热△H=______。
3N2(g)+2CO2(g)+2H2O(l)的反应热△H=______。
(2)用NH3催化还原NOx可以消除氮氧化物的污染。如下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(脱氮率即氮氧化物的转化率),反应原理为:NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g) △H<0。
2N2(g)+3H2O(g) △H<0。
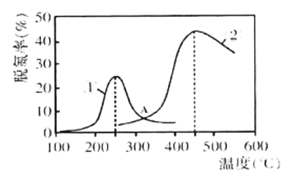
以下说法正确的是______。
A.催化剂①、②分别适合于250℃和450℃左右脱氮
B.使用第②种催化剂更有利于提高NOx的平衡转化率
C.相同条件下,改变压强对脱氮率没有影响
D.在交叉点A处,不管使用哪种催化剂,上述反应都未达平衡。
(3)工业合成尿素的反应如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2,则此时v(正)______v(逆)(填>、<或=)。判断的理由是______。
②若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和1 mol CO2,在40min时重新达到平衡,请在图中画出25~50min内NH3的浓度变化曲线。______。
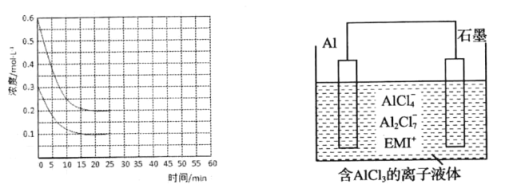
(4)用铝制作的“快速放电铝离子二次电池”的原理如右上图所示(EMI+为有机阳离子、电池工作时离子液体中微粒种类不变)。该电池放电时的负极反应方程式为____________。
-
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图A所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
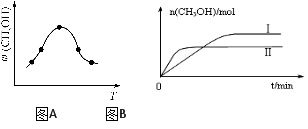
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图B所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>” 或“<”)。
(3)以CO2为原料还可以合成多种物质。①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
-
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭(石墨)作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =2Fe(s)+ 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
若向体积为1L的恒容密闭容器中按下表中三种投料方式投料,发生上述反应.反应温度对CO2平衡转化率影响的曲线(如下图)。
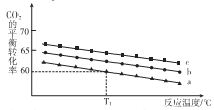
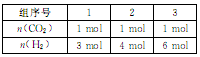
① 该反应的△H_______0(填“>”“<”或“=” ),曲线C对应的投料是第_________组。
② T1℃ 时,曲线a对应的化学平衡常数K=_________(保留两位有效数字)。
③ 若500℃ 时该反应的平衡常数K= 2.5,T1℃________500℃ (填“>”“<”或“=”)。
(3)用电化学的方法也可以将CO2变废为宝,用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应式为____________。
(4)用石灰水就能够将CO2转变成CaCO3,若Ksp(CaCO3)=2.8×10-9,饱和石灰水的物质的量浓度为0.01mol/L,则向1L饱和石灰水中通入_______mLCO2(标准状况),溶液中开始出现沉淀(不考虑反应过程中溶液体积的变化)。
-
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
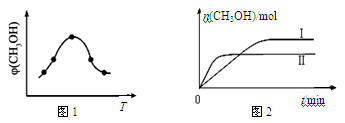
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。判断的理由 。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。开始以氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Kb=4.3×10-7,则NH4HCO3溶液呈 (填“酸性”、“中性”、“碱性”)。
-
(13分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
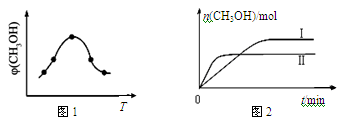
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其发生可逆反应的方程式为 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,请写出该电极反应的方程式为 。
-
研究CO2的利用对促进低碳社会的构建具有重要意义。
⑴ 将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) ΔH 1 = +489.0 kJ·mol-1
C(石墨) + CO2(g) =2CO(g) ΔH 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为___________________________________________。
⑵ 二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g) CH3OH(g) +H2O(g) ΔH
CH3OH(g) +H2O(g) ΔH
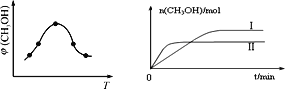
① 取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应ΔH_______0(填“>”、“<”或“=”)。
② 在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为:KⅠ______KⅡ(填“>” 或“<”)。
⑶ 以CO2为原料还可以合成多种物质。①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为_____________________________________。当氨碳比n(NH3 )/n(CO2 )=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为______。
-
(每空2分,共10分)
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应经过相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
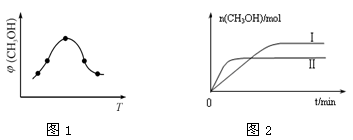
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
④用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
-
(14分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0 (填“>”、“<”或“=”)。
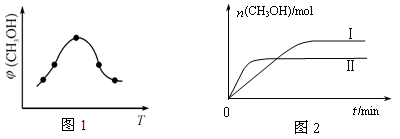
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。
当氨碳比 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为: 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
-
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0 kJ·mol-1 C(石墨)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为____________。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
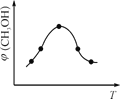
①该反应的平衡常数表达式为K=__________ 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH _____ 0(填“>”、“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____ KⅡ(填“>”、“<”或“=”)。

(3)以CO2为原料还可以合成多种物质,用硫酸溶液作电解质进行电解,CO2在电极上可转化为CH4,该电极应与电源 ___________(填“正极”、“负极”)相连,其电极反应的方程式为______________________。
-
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0 kJ·mol-1 C(石墨)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为____________。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H

①该反应的平衡常数表达式为K=__________ 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH _____ 0(填“>”、“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____ KⅡ(填“>”、“<”或“=”)。

(3)以CO2为原料还可以合成多种物质,用硫酸溶液作电解质进行电解,CO2在电极上可转化为CH4,该电极应与电源 ___________(填“正极”、“负极”)相连,其电极反应的方程式为______________________。
3N2(g)+2CO2(g)+2H2O(l)的反应热△H=______。
2N2(g)+3H2O(g) △H<0。

CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。