-
中国古代炼丹术中蕴含了丰富的化学知识,相关记载不绝于书。下列对炼丹术中相关记载的原理解释不正确的是
选项
相关记载
解释
A.
《抱朴子》:“曾青(CuSO4)涂铁,铁赤色如铜……外变而内不化也。”
发生了铁置换铜单质的反应
B.
《吕氏春秋•别类编》:“金(古代的‘金’往往指铜)柔锡柔,合两柔则刚。”
合金的硬度大于组成它的纯
金属的硬度
C.
《抱朴子》:“丹砂(HgS)烧之成水银,积变又还成丹砂。”
发生了可逆反应:HgS
Hg + S
D.
《周易参同契》:“胡粉[2PbCO3·Pb(OH)2]投火中,色坏还为铅(Pb)。”
此处的“火”中含有炭,将
胡粉发生分解反应生成的铅的氧化物还原为单质铅。
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列化学用语不正确的是
A.氯化铵的电子式:
Cl- B.乙醛的比例模型:
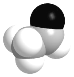
C.中子数为 8 的氧原子是
O D.氯离子的结构示意图是
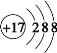
难度: 中等查看答案及解析
-
下列说法不正确的是
A.葡萄糖作为人类重要能量来源,是由于它在人体的酶催化下发生氧化反应,放出能量
B.油脂在一定条件下能发生水解,是由于它属于天然有机高分子
C.生石灰、草木灰等可用于腌制松花蛋,是由于碱性物质能使鸡蛋中蛋白质变性
D.植物油能使酸性高锰酸钾溶液褪色,是由于植物油是含较多不饱和脂肪酸成分的甘油酯
难度: 简单查看答案及解析
-
下列各项比较中,一定相等的是
A.相同质量的 Fe 完全转化为FeCl2和FeCl3 时转移的电子数
B.相同质量的苯和乙炔所含的碳原子的数目
C.标准状况下的 2.24 L HCl 气体和1 L 0.1 mol·L−1盐酸中所含Cl−的数目
D.相同物质的量浓度的NH4Cl和(NH4)2Fe(SO4)2溶液中 NH
的浓度
难度: 中等查看答案及解析
-
一氧化碳甲烷化反应为:CO(g) + 3H2(g) = CH4(g) + H2O(g)。下图是使用某种催化剂时转化过程中的能量变化(部分物质省略)。
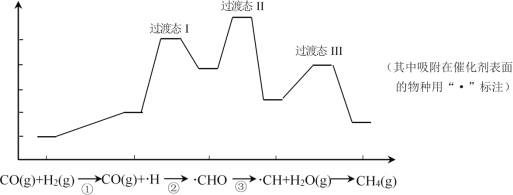
下列说法不正确的是
A.步骤①只有非极性键断裂
B.步骤②的原子利用率为 100%
C.过渡态Ⅱ能量最高,因此其对应的步骤③反应速率最慢
D.该方法可以清除剧毒气体CO,从而保护环境
难度: 简单查看答案及解析
-
下列解释事实的方程式不正确的是
A.84 消毒液(有效成分为NaClO)中加入少量白醋可增强消毒效果:ClO− + CH3COOH = HClO + CH3COO−
B.用 Na2CO3 将水垢中的 CaSO4 转化为易于除去的CaCO3:CaSO4 + CO
= CaCO3 + SO
C.稀硫酸酸化的淀粉−KI 溶液在空气中放置一段时间后变蓝:2I− + SO
+ 4H+ = I2 + SO2 + 2H2O
D.用 Na2S2O3 做碘量法实验时,溶液 pH 不可太低:S2O
+ 2H+ = SO2 + S↓ + H2O
难度: 简单查看答案及解析
-
下列实验能达到目的的是
实验目的
实验方法
A
证明甲苯中的甲基活化了苯环
分别取甲苯和苯与酸性高锰酸钾反应,观察使酸性高锰酸钾溶液褪色的情况
B
除去CuSO4 溶液中的少量 Fe2+、Fe3+
先加入少量 H2O2,再加入 CuO 调节溶液 pH≈4,过滤
C
证明Ag+能将 Fe2+氧化为 Fe3+
取少量 Fe(NO3)2 溶液,加入几滴 KSCN;再加入几滴
AgNO3 溶液(pH=5),观察加入 AgNO3 溶液前后的颜色变化
D
检验 CH3CH2Br 消去反应的产物乙烯
将产物气体直接通入酸性 KMnO4 溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
四种短周期元素 X、Y、Z 和 W 在周期表中的位置如图所示,原子序数之和为 48。下列说法不正确的是
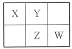
A.原子半径(r)大小比较 r(X)>r(Y)
B.Z 的最低价单核阴离子的还原性比Y 的强
C.X 和 W 可形成共价化合物XW3
D.含氧酸的酸性强弱关系一定是:W>Z
难度: 简单查看答案及解析
-
某小组同学自酿米酒,具体步骤如下:
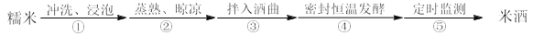
定时监测获得的实验数据图如下:
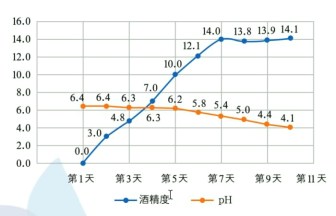
下列说法不正确的是
A.糯米中淀粉在酒曲中糖化酶作用下水解为葡萄糖,葡萄糖在酒化酶作用下转化为乙醇
B.酿造过程中米酒 pH 逐渐下降,可能是因为部分乙醇被空气氧化为乙酸
C.从第 7 天开始米酒的酒精度近乎不变,说明溶液中的葡萄糖已经完全反应
D.该小组最终酿出的米酒酒精度不高,可采用蒸馏法提高酒精度
难度: 简单查看答案及解析
-
由 N−乙烯基吡咯烷酮(NVP)和甲基丙烯酸 β−羟乙基(HEMA)合成水凝胶材料高聚物A 具有较高的含水量,其路线如下图所示:
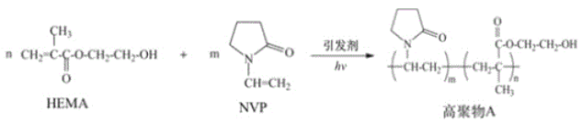
下列说法不正确的是
A.HEMA 的水解产物均可用作聚合反应的单体
B.高聚物A 因含有多个—OH 而具有良好的亲水性
C.HEMA 和 NVP 通过缩聚反应生成高聚物 A
D.若将高聚物A 与足量HOOC(CH2)4COOH 反应,可能通过形成新的酯基,进而交联形成网状结构
难度: 中等查看答案及解析
-
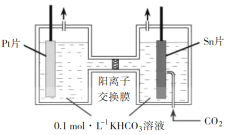
一种锂离子电池的反应式为 LixC6 + Li1−xCoO2
6C+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是

A.放电时,A 极电极式为:LixC6 − xe− = 6C + xLi+
B.放电时,若转移 0.3 mol 电子,石墨电极将减重 2.1g
C.充电时,Li+从左向右移动
D.若要从废旧该型锂电池的正极材料中回收锂元素,先进行放电处理,有利于 Li+尽可能从负极脱出,在正极富集
难度: 简单查看答案及解析
-
用 0.1000 mol·L−1 NaOH 溶液分别滴定 20.00 mL 0.1000 mol·L−1 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
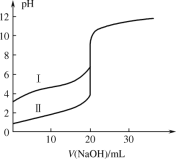
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH) = 10.00 mL 时,醋酸溶液中c(CH3COOH)<c(CH3COO−)
C.pH = 7 时,滴定盐酸消耗的 NaOH 溶液体积小于滴定醋酸消耗的 NaOH 溶液体积
D.V(NaOH) = 20.00 mL 时,两溶液中 c(CH3COO−)=c(Cl−)
难度: 中等查看答案及解析
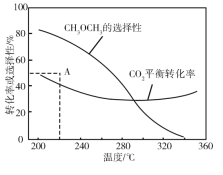
-
反应 2SiHCl3(g)
SiH2Cl2(g) + SiCl4(g)在催化剂作用下,于 323 K 和 343 K 时充分反应,SiHCl3 的转化率随时间变化的结果如图所示:

下列说法不正确的是
A.343 K 时反应物的平衡转化率为 22%
B.a、b 处反应速率大小:va>vb
C.要提高 SiHCl3 转化率,可采取的措施是降温和及时移去反应产物
D.已知反应速率
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,则 343 K 时
难度: 中等查看答案及解析
-
水浴加热滴加酚酞的NaHCO3溶液,颜色及pH随温度变化如下(忽略水的挥发):
时间
①
②
③
④
⑤
温度/℃
20
30
40
从40℃冷却到20℃
沸水浴后冷却到20℃
颜色变化
红色略加深
红色接近①
红色比③加深较多
pH
8.31
8.29
8.26
8.31
9.20
下列说法不正确的是( )
A.NaHCO3溶液显碱性的原因:HCO3-+H2O
H2CO3+OH-
B.①→③的过程中,颜色加深的原因可能是HCO3-水解程度增大
C.①→③的过程中,pH略微下降说明升温过程中c(OH-)减小
D.⑤比①pH增大,推测是由于NaHCO3分解生成的Na2CO3的缘故
难度: 困难查看答案及解析
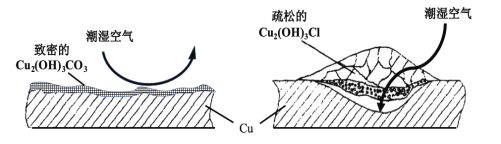
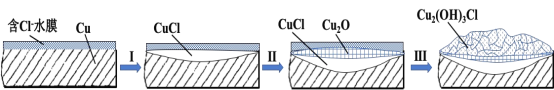
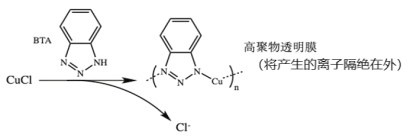
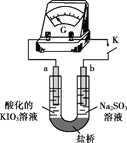
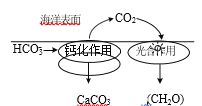
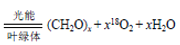
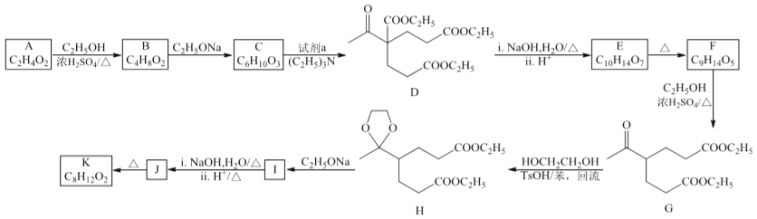
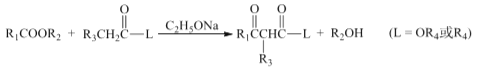
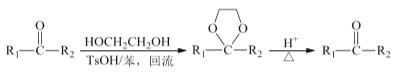
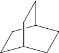
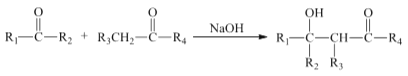 。由 K 在NaOH 作用下反应得到化合物 M,该物质具有如下图所示的二环[2.2.2]辛烷的立体结构,请在图中补充必要的官能团得到完整的 M 的结构简式。__________________
。由 K 在NaOH 作用下反应得到化合物 M,该物质具有如下图所示的二环[2.2.2]辛烷的立体结构,请在图中补充必要的官能团得到完整的 M 的结构简式。__________________