-
对于反应2A+B
3C+4D,表示反应速率最快的是
A.VA=0.75mol/(L·s) B.VB=0.5mol/(L·s) C.VC=1.0mol/(L·s) D.VD=1.5mol/(L·s)
难度: 简单查看答案及解析
-
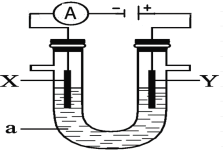
室温下将相同质量的锌粉放入下列溶液中,开始时生成氢气的速率最大的是
A.0.1mol/L硫酸 B.0.1mol/L氢硫酸 C.0.1mol/L醋酸 D.0.1mol/L盐酸
难度: 简单查看答案及解析
-
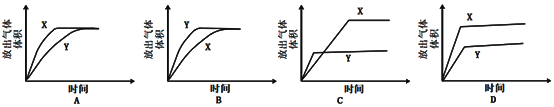
浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,达到平衡后c(X(2)为0.4mol/L,c(Y(2)为0.8mol/L,生成的c(Z)为0.4mol/L,则该反应是
A.3X2+Y2
2X3Y B.X2+3Y2
2XY3 C.X2+2Y2
2XY2 D.2X2+Y2
2X2Y
难度: 简单查看答案及解析
-
一定条件下某容器中各微粒在反应前后的变化如图所示,其中●和◯代表不同元素的原子。关于此反应说法错误的是
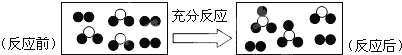
A.一定属于化合反应
B.一定属于可逆反应
C.一定属于吸热反应
D.一定属于氧化还原反应
难度: 简单查看答案及解析
-
一定温度下,一密闭容器中有如下反应:4CO(g)+2NO2(g)
N2(g)+4CO2(g),下列叙述中不能说明该反应一定达到了平衡状态的是
A.单位时间内有amolCO参加反应,同时也有amolCO2参加反应
B.NO2的生成速率:N2的消耗速率=2:1
C.CO的消耗速率:NO2的生成速率=2:1
D.NO2的消耗速率:CO2的消耗速率=1:2
难度: 简单查看答案及解析
-
在容积固定的密闭容器中,不能够用以判断某条件下反应2NO+O2⇌2NO2已经达到平衡的是下列中的
A.混合气体颜色的变化 B.混合气体密度的变化
C.混合气体温度的变化 D.容器内总压强的变化
难度: 简单查看答案及解析
-
一定温度下,在一个2L的密闭容器中加入3mol A和2.5mol 的B,发生如下反应3A(气)+B(气)⇌xC(气)+2D(气),5分钟后反应达到平衡时,测的容器内的压强变小,同时C为0.25mol/L。下列结论错误的是
A.平衡时,A的浓度为0.75mol/L
B.平衡时, B的转化率为20%
C.D的平均反应速率为0.1mol/(L·min)
D.反应开始至平衡的过程中混合气体的平均相对分子质量在减小
难度: 简单查看答案及解析
-
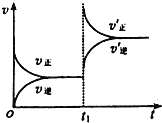
可逆反应aX(g)+b Y(g)
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(u)一时间(t)图象如下图。则下列说法中正确的是( )
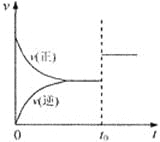
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
难度: 中等查看答案及解析
-
对已经达到平衡的下列体系,只改变一个条件,对平衡移动的方向判断错误的是
A.CaCO3(s)
CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
B.4NH3(g) +5O2(g)
4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
C.HS- + H2O
H3O + S2- ,加水稀释,平衡向逆反应方向移动
D.H2(g) + I2(g)
2HI(g) :扩大容器体积,平衡不移动
难度: 简单查看答案及解析
-
在碘水中加入KI发生如下反应:I2(aq)+I−(aq)
I3-(aq)(aq表示水溶液)。某I2、KI混合溶液中,c(I3-)在不同温度下的平衡平衡浓度与温度T的关系如图曲线所示。下列说法不正确的是
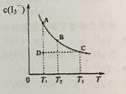
A.反应I2(aq)+I−(aq)
I3-(aq) 是放热反应
B.压强变化对该平衡影响不大
C.状态D时,v正<v逆
D.状态A与状态B相比,状态A的c(I2) 小
难度: 简单查看答案及解析
-
在一定温度,将各为1mol的CO和水蒸气放在体积不变密闭容器反应:CO(g) +H2O(g)
H2(g) + CO2(g)达到平衡后测得CO2为0.6mol,再通入4mol的水蒸气达到新的平衡,下列说法错误的是()
A.CO2的物质的量不可能为1mol B.水蒸气的转化率提高
C.CO2的浓度比水蒸气的浓度小 D.密闭容器的压强是原先的3倍
难度: 中等查看答案及解析
-
下列现象不能用勒沙特列原理解释的是()
A.铵态氮肥不能与碱性物质共用
B.酚酞溶液中滴加氢氧化钠溶液,溶液变红
C.对0.1mol/L的碳酸氢钠溶液加热,使其PH变大
D.同中浓度硫代硫酸钠与稀硫酸反应温度较高的溶液变浑浊的速度较快
难度: 简单查看答案及解析
-
在接触法制硫酸和合成氨工业的生产过程中,下列说法错误的是()
A.硫铁矿在燃烧前要粉碎,目的是使硫铁矿充分燃烧,加快反应速率
B.二氧化硫的催化氧化反应的温度控制在450度左右,主要考虑到催化剂V2O5的活性温度
C.吸收塔中用98.3%的浓硫酸代替水吸收SO3,以提高效率
D.工业上为提高反应物N2、H2的转化率和NH3的产量和反应速率,常在合成氨反应达到平衡后再分离氨气
难度: 简单查看答案及解析
-
下列化合物属于强电解质的是
A.NH4NO3 B.H2CO3 C.H2O D.SO2
难度: 简单查看答案及解析
-
下列电离方程式正确的是
A.H2S
2H++S2- B.HClO
H++ClO-
C.H2O
2H++O2- D.CH3COONH4
NH4++CH3COO-
难度: 简单查看答案及解析
-
化合物Hln在水溶液中存在电离平衡:HIn(红色)⇌H++In-(黄色),故可用做酸碱指示剂。下列稀溶液中能使指示剂由黄色变为红色的是
A.盐酸 B.氢氧化钠溶液 C.食盐溶液 D.氨水
难度: 简单查看答案及解析
-
下列反应可用离子方程式H++OH-=H2O表示的是
A.硝酸和氢氧化铜 B.盐酸和氢氧化钡
C.醋酸和氢氧化钠 D.氢硫酸和氢氧化钾
难度: 简单查看答案及解析
-
下列离子方程式中不正确的是
A.硫化亚铁与盐酸反应制取硫化氢气体:FeS+2H+=Fe2++H2S↑
B.碳酸氢钙溶液加入过量的氢氧化钙:Ca2++ OH- + HCO3-=CaCO3↓+H2O
C.碳酸银溶解于稀硝酸中:Ag2CO3+2H+=2Ag++CO2↑+H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液共热: HCO3-+NH4++OH-=CO32-+NH3↑+H2O
难度: 简单查看答案及解析
-
某无色溶液中存在大量的Ba2+、NH4+、Cl-,该溶液中还可能大量存在的离子是( )
A. Fe3+ B. CO32- C. Mg2+ D. OH-
难度: 简单查看答案及解析
-
在pH=0的溶液中,下列各组离子能大量共存的是
A.Ba2+ Na+ Cl- S2O32- B.Mg2+ Cu2+ SO32- SO42-
C.NH4+ K+ NO3- SO42- D.K+ Al3+ NO3- HCO3-
难度: 简单查看答案及解析
-
某未知溶液可能含Cl-、CO32-、Na+、SO42-、Cu2+。将溶液滴在蓝色石蕊试纸上试纸变红;取少量试液,先滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,再在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是
A.一定没有Na+、Cl-
B.可能有Cl-、CO32-
C.一定没有CO32-、可能有SO42-
D.一定有SO42-、Cu2+
难度: 中等查看答案及解析
-
下列溶液中,滴入酚酞溶液会显红色的是
A.氯化铜 B.硫化钾 C.硫酸钾 D.硝酸铵
难度: 简单查看答案及解析
-
在0.01mol/L醋酸中存在下列平衡:CH3COOH
H++CH3COO-,若要使溶液的pH和c( CH3 COO-)均减小,可采取的措施是
A.适当升高温度 B.加入稀盐酸 C.加入 CH3COONa固体 D.加入少量水
难度: 简单查看答案及解析
-
下列溶液等体积混合后,对于所得溶液的pH值判断正确的是
A.pH=11的氨水和pH=3的硫酸:pH<7
B.pH值=2的硝酸和pH=12的氢氧化钡:pH>7
C.浓度均为0.01mol/L酸和碱:pH=7
D.浓度均为0.01mol/L的强酸和强碱:pH>7或pH<7,也可能pH=7
难度: 简单查看答案及解析
-
现有同体积、浓度均为0.01mol/L的盐酸和醋酸,下列说法中错误的是
A.若分别与同浓度NaOH溶液恰好完全反应,则消耗NaOH溶液的体积:盐酸=醋酸
B.若分别与同浓度NaOH溶液反应后pH=7,则消耗NaOH溶液的体积:盐酸<醋酸
C.若分别与足量的Na2CO3反应,产生的CO2气体的量:盐酸=醋酸
D.若分别与等量的Na2CO3粉末反应,一开始产生气体的速率:盐酸>醋酸
难度: 简单查看答案及解析
-
较强酸可以制取较弱酸,已知酸性H2CO3> HBrO>HCO3-,则可能发生的反应是
①2HBrO+Na2CO3→2NaBrO+CO2↑+H2O ②NaBrO+NaHCO3→HBrO+Na2CO3 ③HBrO+Na2CO3→2NaBrO+NaHCO3 ④NaBrO+CO2+H2O→NaHCO3+HBrO
A.③④ B.①② C.②④ D.上述答案均不对
难度: 简单查看答案及解析
-
下列实验中的操作中不能达到目的的是
A.在用锌粒与稀硫酸反应制取氢气过程中,加入少量硫酸铜溶液,可加快反应速率
B.在用氯化铁固体和蒸馏水配制氯化铁溶液的过程中,加入少量稀盐酸,可抑制Fe3+水解而得到澄清的溶液
C.在电解水的过程中,加入少量氢氧化钠溶液,可增强导电性
D.将一定量的CO2通入氢氧化钠溶液后,加入酚酞溶液,可确定溶液中溶质的组成
难度: 中等查看答案及解析
-
室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述错误的是
A.溶液的体积:10V甲≤V乙
B.水电离出的OH-浓度:10c(OH-)甲=c(OH-)乙
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙
难度: 中等查看答案及解析