-
属于电解质,且溶于水时会影响水的电离平衡的是
A. 氯气 B. 二氧化碳 C. 碘化钾 D. 醋酸钠
难度: 中等查看答案及解析
-
下列化学用语表述正确的是
A.S2-的结构示意图:
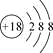
B.氮原子的轨道表示式:
C.CO2的比例模型:
D.氨气分子的结构式:
难度: 中等查看答案及解析
-
下列变化过程中,破坏极性共价键的是
A.碘的升华 B.硅的熔化 C.食盐电离 D.氯化氢溶于水
难度: 简单查看答案及解析
-
下列各组物质的熔点均与所含化学键的键能有关的是
A.CaCl2、SiO2 B.NaCl、HCl C.CaO、CO2 D.Cl2、I2
难度: 中等查看答案及解析
-
某晶体中含有极性键,关于该晶体的说法错误的是
A.可能是有机物 B.不可能是单质
C.不可能有很高的熔沸点 D.可能是离子晶体
难度: 简单查看答案及解析
-
下列有关HCl和HBr的叙述错误的是
A.键能:HBr>HCl B.键长:HBr>HCl
C.沸点:HBr>HCl D.共用电子对偏向:HCl>HBr
难度: 简单查看答案及解析
-
氨气和氟气发生反应:4NH3+3F2=NF3+3NH4F。下列有关NF3说法错误的是
A.NF3分子呈三角锥形 B.NF3分子是极性分子
C.NF3与NH3晶体类型相同 D.NF3熔沸点低于NH3,因为N-F键能低
难度: 中等查看答案及解析
-
把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s)⇌Ca2++2OH-,如在其中加入少量CaO后,恢复到原温度,下列说法正确的是
A.溶液的pH不变 B.溶液质量不变
C.溶质质量不变 D.氢氧根浓度增大
难度: 中等查看答案及解析
-
对于反应 3H2(g)+N2(g)
2NH3(g),能增大正反应速率的措施是
A.移去部分NH3 B.恒容下充入Ar气
C.通入大量NH3 D.降低体系温度
难度: 简单查看答案及解析
-
反应2H2O2(l)
2H2O(l)+O2(g)能量变化如图所示,下列说法错误的是
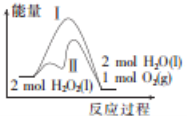
A.该反应放热
B.反应速率:途径Ⅱ>途径Ⅰ
C.1 mol H2O2(l)的能量高于1 mol H2O(l)的能量
D.途径Ⅰ放出的热量多
难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成H2的总量,可向反应容器中加入适量的
A.NaOH B.NaAc C.NH4Cl D.Na2CO3
难度: 中等查看答案及解析
-
可逆反应达到平衡时,下列物理量发生变化,平衡一定发生移动的是( )
A.反应物的浓度 B.反应物的转化率
C.正、逆反应速率 D.体系的压强
难度: 中等查看答案及解析
-
一定条件下发生反应:CO(g)+2H2(g)
CH3OH(g)。恒容条件下,下列能使
增大的有
A.升高温度 B.充入CO气体
C.再充入1 mol CO和2 mol H2 D.使用催化剂
难度: 中等查看答案及解析
-
下列能用勒夏特列原理解释的事实是
A.碳酸钙不溶于水,但溶于盐酸
B.由2NO2(g)⇌N2O4(g) 组成的平衡体系,加压后颜色加深
C.工业上选择常压条件合成SO3
D.选择450℃左右的温度合成氨
难度: 中等查看答案及解析
-
将小块生铁分别置于少量的饱和食盐水或稀醋酸溶液中,一定时间后可观察到的现象是
A.
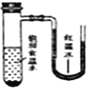 B.
B.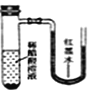 C.
C.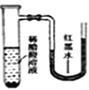 D.
D.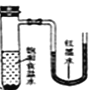
难度: 中等查看答案及解析
-
酸HX的下列性质中,可以证明它是弱电解质的是
A.1 mol/LHX溶液的pH值约为2
B.HX能与水以任意比互溶
C.等物质的量HX与NaOH溶液完全反应
D.HX溶液的导电性比强酸溶液的弱
难度: 中等查看答案及解析
-
25℃时,向0.1 mol/L醋酸中加入少量NaAc固体,肯定减小的是
A.c(H+)·c(OH-) B.溶液的导电能力 C.
D.c(OH-)
难度: 中等查看答案及解析
-
一定条件下。RO3-与R-可发生反应:RO3-+5R-+6H+=3R2+3H2O,下列叙述正确的是
A.元素R位于周期表中第ⅤA族
B.RO3-中的R只能被还原
C.R2在常温下一定是气体
D.若1 mol RO3-参与该反应,则转移的电子的物质的量为5 mol
难度: 中等查看答案及解析
-
甲~辛等元素在周期表中的相对位置如表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
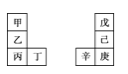
A.丙与庚的原子序数相差3
B.气态氢化物的热稳定性:戊>己>庚
C.乙所在周期元素中,其简单离子的半径最大
D.常温下甲的单质在水中反应要比乙剧烈很多
难度: 中等查看答案及解析
-
将l00ml 1mol/L 的NaHCO3溶液等分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中c(CO32-)的变化分别是
A.减小、减小 B.减小、增大 C.增大、增大 D.增大、减小
难度: 中等查看答案及解析