-
关于以下科技成果,下列说法正确的是( )
A.中国“人造太阳”
B.电磁炮成功装船
C.“鲲龙”两栖飞机
D.“墨子”通信卫星
利用氘和氚发生化学反应产生上亿度高温
电磁炮发射过程中电能转化为机械能
飞机大量使用熔点高、硬度大的铝锂合金
通讯中使用的光导纤维主要成分是单晶硅
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
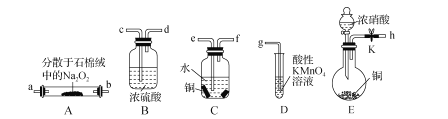
下列有关实验操作的现象和结论均正确的是( )
选项
实验操作
现象
结论
A
分别向相同浓度的ZnSO4溶液和溶液中通入足量H2S
前者无现象,后者有黑色沉淀生成
Ksp(ZnS)< Ksp(CuS)
B
常温下,分别测等浓度的NaX溶液和Na2CO3溶液的pH
前者pH小于后者
酸性:HX >H2CO3
C
将铜粉加入FeCl3溶液中
溶液变蓝,有黑色固体出现
金属铁比铜活泼
D
将表面附有黑色的Ag2S银器浸入盛有食盐水的铝质容器中
黑色逐渐褪去
银器为正极,Ag2S得电子生成单质银
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
杂环化合物是分子中含有杂环结构的有机化合物。常见的六元杂环化合物有
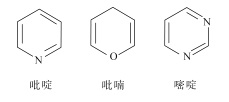
下列说法正确的是( )
A.吡啶和嘧啶互为同系物
B.吡喃的二氯代物有6种(不考虑立体异构)
C.三种物质均能发生加成反应
D.三种分子中所有原子处于同一平面
难度: 中等查看答案及解析
-
含有酚类物质的废水来源广泛,危害较大。含酚废水不经处理排入水体,会危害水生生物的繁殖和生存;饮用水含酚,会影响人体健康。某科研结构研究出一种高效光催化剂BMO(Bi2MoO6),可用于光催化降解丁基酚,原理如图所示。下列说法错误的是( )
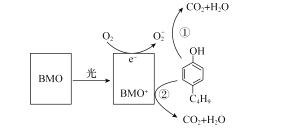
A.光催化剂BMO可降低丁基酚氧化反应的ΔH
B.在丁基酚氧化过程中BMO表现出强还原性
C.苯环上连有一OH和一C4H9的同分异构体共有12种(不考虑立体异构)
D.反应中BMO参与反应过程且可以循环利用
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的四种短周期主族元素,Y、Z的最外层电子数之和等于W的原子序数,Z元素在地壳中含量最高。Y元素的最高价氧化物对应的水化物与其氢化物化合生成盐。常温下,X的单质为气体。下列说法正确的是( )
A.简单阴离子的还原性:X>Y
B.原子半径:W>Z>Y>X
C.Z与W形成的化合物中只含有离子键
D.简单氢化物的沸点:Y>Z
难度: 中等查看答案及解析
-
第20届中国国际工业博览会上,华东师范大学带来的一种“锌十碘”新型安全动力电池亮相工博会高校展区。该新型安全动力电池无污染、高安全、长寿命且具有合适的充电时间,可以应用于日常生活、交通出行等各个领域。已知该电池的工作原理如图所示。下列有关说法正确的是( )
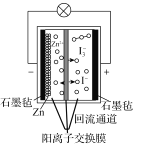
A.正极反应式为I3--2e-=3I-
B.6.5gZn溶解时,电解质溶液中有0.2mol电子移动
C.转移1mol电子时,有1molZn2+从左池移向右池
D.“回流通道”可以减缓电池两室的压差,避免电池受损
难度: 困难查看答案及解析
-
室温下,用0.20mol·L-1的NaOH溶液滴定10.00mL 0.20mol·L-1的NaHSO3溶液,滴定过程中溶液的pH变化和滴加NaOH溶液的体积关系如图所示。下列说法错误的是( )

A.溶液中水的电离程度:b>a>c
B.pH=7时,消耗的V(NaOH)<10.00mL
C.在室温下K2(H2SO3)约为1.0×10-7
D.c点溶液中c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
难度: 中等查看答案及解析

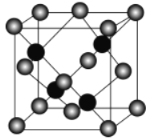

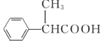 的同分异构体有__种(不考虑立体异构)。
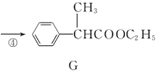
的同分异构体有__种(不考虑立体异构)。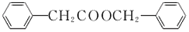 合成路线图___。
合成路线图___。 B
B