-
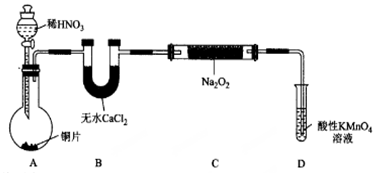
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。
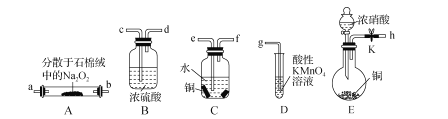
已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO3-;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是_____,检査装置E气密性的方法是_____。
(2)上述实验装置中,依次连接的合理顺序为h-_____。
(3)装置D中酸性KMnO4溶液的作用是_____(用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为_____。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol/L酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为_____mg·L-1。若所取样品在空气中放置时间过长,则测定结果_____(填“偏高”“偏低”或“无影响”)。
有关反应如下:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O。
-
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。

已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO3-;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是_____,检査装置E气密性的方法是_____。
(2)上述实验装置中,依次连接的合理顺序为h-_____。
(3)装置D中酸性KMnO4溶液的作用是_____(用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为_____。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol/L酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为_____mg·L-1。若所取样品在空气中放置时间过长,则测定结果_____(填“偏高”“偏低”或“无影响”)。
有关反应如下:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O。
-
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
(制取NaNO2)
设计的制取装置如下图(夹持装置略去):
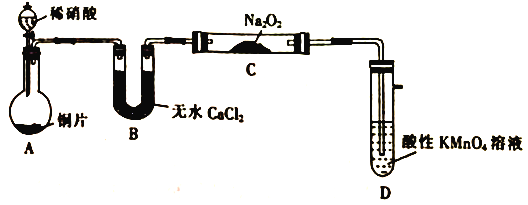
该小组查阅资料可知:①2NO+Na2O2=2NaNO2、2NO2+Na2O2=2NaNO3;
②NO能被酸性高锰酸钾氧化为NO3-。
(1)装置A中用于盛放稀硝酸的仪器名称为____________,装置A中发生主要反应的离子方程式为____________________________________。
(2)装置D的作用是____________________________________。
(3)若无装置B,则进入装置D中的气体除N2、NO外还可能有__________________。
(4)甲同学检查装置气密性后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列可以提高NaNO2纯度的方案是_________(填字母)。
a.将B中的药品换为碱石灰 b.将稀硝酸换为浓硝酸
c.实验开始前通一段时间CO2 d.在装置A、B之间增加盛有水的洗气瓶
(测定制得的样品中NaNO2的含量)
(5)该实验中需配制KMnO4标准溶液并酸化,应选择_________(填化学式)来酸化KMnO4溶液。
(6)已知:在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定样品中亚硝酸钠的含量,该小组称取4.0g样品溶于水配制成250mL溶液,取25.00mL溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液进行滴定,消耗20.00mL酸性KMnO4溶液。滴定过程中酸性KMnO4溶液的作用是__________________,所得样品中NaNO2的质量分数为_________。
-
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【制取NaNO2】
设计的制取装置如下图(夹持装置略去):
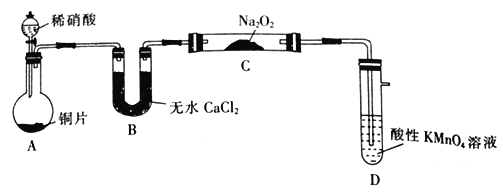
该小组先查阅资料知:①2NO+Na2O2 =2NaNO2;2NO2+Na2O2 =2NaNO3;
②NO能被酸性高锰酸钾氧化为NO3-,
(1)装置A中用于盛放稀硝酸的仪器名称为_______________,装置A中发生主要反应的离子方程式为_____________________________。
(2)装置D的作用是_____________________________。
(3)若无装置B,则进入装置D中的气体除N2、NO外还可能有_____________________________。
(4)甲同学检查装置气密性后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列可以提高NaNO2纯度的方案是____________(填字母)。
a.将B中的药品换为碱石灰 b.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 d.在装置A、B之间增加盛有水的洗气瓶
【测定制得样品中NaNO2的含量】
(5)该实验中需配制KMnO4标准溶液并酸化,应选择_______(填化学式)来酸化KMnO4溶液。
(6)已知:在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定样品中亚硝酸钠的含量,该小组称取4.0 g样品溶于水配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.100 mol·L-1的酸性KMnO4 溶液进行滴定,消耗20.00 mL酸性KMnO4溶液。滴定过程中酸性KMnO4溶液的作用是_______________,所得样品中NaNO2的质量分数为______________。
-
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
(实验Ⅰ)制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
制备装置如图所示(夹持装置略去):

(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为____________。
(2)如果没有B装置,C中发生的副反应有_____________、____________。
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。于是进行了适当的改进,改进后提高了NaNO2的纯度,则其改进措施是________________________________。
(实验Ⅱ)测定制取的样品中NaNO2的含量
步骤:
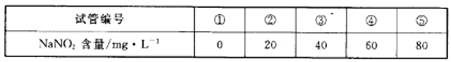
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/(mg·L-1) | 0 | 20 | 40 | 60 | 80 |
b.称量0.10 g制得的样品,溶于水配成500 mL溶液。取5 mL待测液,加入1 mL M溶液,再加蒸馏水至10 mL并振荡,与标准色阶比较。
(4)步骤b中比较结果是:待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2的质量分数是________。
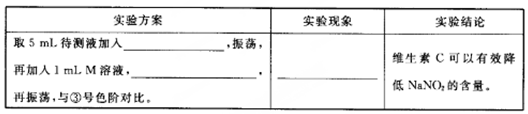
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
| 实验方案 | 实验现象 | 实验结论 |
| 取5 mL待测液,加入______________,振荡,再加入1 mL M溶液,_______________,再振荡,与③标准色阶对比 | _______________ | 维生素C可以有效降低NaNO2的含量 |
-
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
②NO能被酸性高锰酸钾氧化为NO3-。
设计制备装置如下(夹持装置略去)。
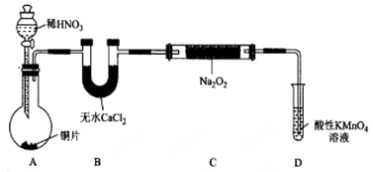
(1)装置A中用于盛放稀HNO3溶液的仪器名称为___________________;
写出装置A中发生主要反应的离子方程式 。
(2)装置D的作 用为_________________。
用为_________________。
(3)如果没有B装置,写出C中发生副反应的化学方 程式①_______________、②____________。
程式①_______________、②____________。
(4)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。请设计一种提高NaNO2纯度的改进措施 。
【实脸II】测定制取的样品中NaNO2的含量
步骤:已知在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO 4溶液进行滴定,实验所得数据如下表所示:
4溶液进行滴定,实验所得数据如下表所示:

(5)根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。
-
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2N0+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
设计制备装置如下(夹持装置略去)。
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为_______________。
(2)如果没有B装置,C中发生的副反应有____________。
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。于是在A 与B 装且间增加了___________装置,改进后提高了NaNO2的纯度。
【实脸II】 测定制取的样品中NaNO2的含量
步骤:
A.在5个有编号的带刻度试管(比色管)中分别加人不同址的NaNO2溶液,各加入1 ml的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
b.称量0.10g制得的样品溶于水配成500 ml溶液。取5mL待测液,加入1mlM溶液,后加蒸馏水至10mL振荡,与标准色阶比较。
(4)步脚b中比较结果:待测液颜色与③号色阶相同。则甲同学制得的样品中NaNO2的质量分数是______%。
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
-
亚硝酸为弱酸,其钠盐(亚硝酸钠NaNO2)外观酷似食盐且有咸味,过量使用会使人中毒。其银盐不溶于水。某化学兴趣小组对亚硝酸钠的制备进行了探究。
(1)请设计一种简单方法鉴别NaCl和NaNO2 :___________。
(2)利用如图完成一氧化氮与过氧化钠反应制备业硝酸钠。查阅资料:2NO + Na2O2 =2NaNO2, 2NO2+ Na2O2=2NaNO3, NO 能被酸性高锰酸钾氧化为NO3-。回答下列问题:
① 检查装置气密性后,应进行的操作是_________。
② 装置B 中Cu 参与反应的离子方程式为______,装置C 的作用是______。
③ 装置E发生反应的离子方程式为________。
④ 同学们经过讨论认为上述装置仍然存在缺陷,D中生成的产物不纯,D管中可能含有的杂质为________(填化学式),你认为应该进行的改进是__________。
(3)测定制取样品中NaNO2的纯度。
步骤:a.在5个有编号的带刻度的试管中分别加入不同体积、相同浓度的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL,并振荡,制成标准色阶;
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量(mg/L) | 0 | 20 | 40 | 60 | 80 |
b.称量0.10g制得的样品,溶于水配成500mL溶液。取5mL待测液,加入1mLM,再加入蒸馏水至l0mL,并振荡,与标准色阶比较。
比较结果:待测液与④标准色阶相同,则制取样品中NaNO2的纯度是________。
查阅资料可知:维生素C可有效降低NaNO2的含量。请完成下列实验验证方案:取5 mL 待测液,加入______,振荡,再加入1mL M溶液,_____,再振荡,与④ 标准色阶对比。实验现象为紫红色比④ 标准色阶浅,则证明维生素C可以有效降低NaNO2的含量。
-
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【实验Ⅰ】制取NaNO2
该小组先查阅资料知:①2NO+Na2O2 →2NaNO2;2NO2+Na2O2 →2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如下图(夹持装置略去):
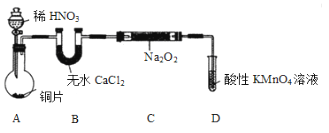
(1)装置A中用于盛放稀HNO3溶液的仪器名称为________;写出装置A中发生主要反应的离子方程式:__________。
(2)装置D的作用是____________;
(3)如果没有B装置,C中发生的副反应的化学方程式①_______ 、②______。
(4)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列哪种方案可以提高NaNO2纯度________。
A.将B中的药品换为碱石灰 B.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 D.在A、B之间增加盛有水的洗气瓶
【实验Ⅱ】测定NaNO2样品中NaNO3的含量
步骤:(1)配置KMnO4标准溶液并酸化,酸化KMnO4的酸应选择________(填化学式)
(2)已知在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,消耗KMnO4 20.00mL,酸性KMnO4的作用是______和_______,计算所得固体中亚硝酸钠的质量分数__________。(结果保留一位小数)
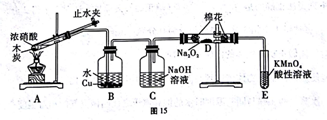
【扩展实验Ⅲ】该学习小组为再了解氧族元素的一些典型化合物的性质,进行了如下实验探究。
经查知:硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分 可能是SO2、SO3和O2中的一种、两种或三种。他们通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如图所示:
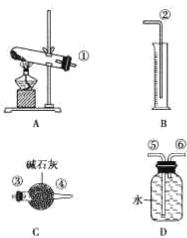
(1)提出猜想
①所得气体的成分可能只含________一种;
②所得气体的成分可能含有________两种;
③所得气体的成分可能含有SO2、SO3和O2三种。
(2)实验探究
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
①请你组装探究实验的装置,按从左至右的方向,则仪器接口的连接顺序为______ (填序号)。
②由于加热时的温度不同,实验结束后测得相关数据也不同。数据如下:
| 实验 | 称取CuSO4的质量/g | 仪器C 增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 第一组 | 6.4 | 2.88 | 224 |
| 第二组 | 6.4 | 2.56 | 448 |
请通过计算,推断出第一组和第二组的实验条件下CuSO4分解反应的化学方程式:
第一组_________________; 第二组_________________。
-
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【实验一】制取NaNO2
该小组先查阅资料知:①2NO+Na2O2 →2NaNO2;2NO2+Na2O2 →2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如下图(夹持装置略去):
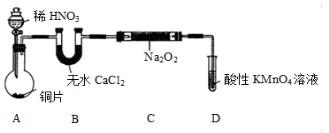
36.装置D的作用是 ;如果没有B装置,C中发生的副反应有 。
37.就算在装置气密性良好的情况下进行实验,该小组发现制得的NaNO2的纯度也不高,可能的原因是 ;设计一种提高NaNO2纯度的改进措施 。
【实验二】测定NaNO2样品(含NaNO3杂质)的纯度
先查阅资料知:①5NO2-+ 2MnO4-+ 6H+ → 5NO3-+ 3Mn2+ + 3H2O;
②MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
然后,设计如下方案测定样品的纯度。

38.取样品2.3g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500mol/L的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000mol/L (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为_________。
39.通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是 (填字母编号)。
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长














