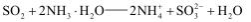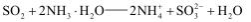-
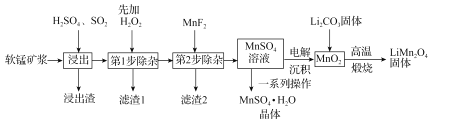
锰酸锂(LiMn2O4)是新型锂离子电池常用的正极材料。工业上以软锰矿浆为原料可制备锰酸锂,同时制得副产品MnSO4·H2O晶体,其流程如图所示。
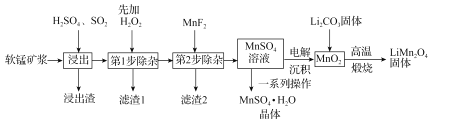
已知:(1)软锰矿浆的主要成分为MnO2,还含有Fe2O3,MgO、Al2O3,CaO,SiO2等杂质。
(2)温度高于27℃时,MnSO4晶体的溶解度随温度升高而逐渐降低。
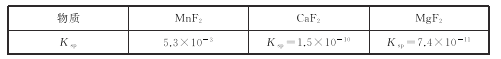
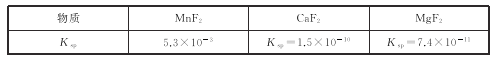
(3)有关物质的溶度积常数如下表:
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为_____。该过程中,为提高软锰矿中MnO2的浸出率,下列措施可行的有_____(填字母)。
A.不断搅拌,使SO2和软锰矿浆充分接触
B.增大通入SO2的流速
C.适当升温
D.减少软锰矿浆的进入量
(2)第1步除杂中加入H2O2的目的是_____。
(3)第2步除杂,主要是将Ca2+,Mg2+转化为相应的氟化物沉淀除去,其中MnF2除去Mg2+反应的离子方程式为MnF2(s)+Mg2+(aq)=Mn2+(aq)+MgF2(s),该反应的平衡常数为_____。
(4)图中的一系列操作指的是_____。
(5)将MnO2和Li2CO3按4:1的物质的量之比配料,混合搅拌,然后高温煅烧600~750℃,制取产品LiMn2O4。写出该反应的化学方程式:_____。
-
锰酸锂(LiMn2O4)是新型锂离子电池常用的正极材料。工业上以软锰矿浆为原料可制备锰酸锂,同时制得副产品MnSO4·H2O晶体,其流程如图所示。
已知:(1)软锰矿浆的主要成分为MnO2,还含有Fe2O3,MgO、Al2O3,CaO,SiO2等杂质。
(2)温度高于27℃时,MnSO4晶体的溶解度随温度升高而逐渐降低。
(3)有关物质的溶度积常数如下表:
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为_____。该过程中,为提高软锰矿中MnO2的浸出率,下列措施可行的有_____(填字母)。
A.不断搅拌,使SO2和软锰矿浆充分接触
B.增大通入SO2的流速
C.适当升温
D.减少软锰矿浆的进入量
(2)第1步除杂中加入H2O2的目的是_____。
(3)第2步除杂,主要是将Ca2+,Mg2+转化为相应的氟化物沉淀除去,其中MnF2除去Mg2+反应的离子方程式为MnF2(s)+Mg2+(aq)=Mn2+(aq)+MgF2(s),该反应的平衡常数为_____。
(4)图中的一系列操作指的是_____。
(5)将MnO2和Li2CO3按4:1的物质的量之比配料,混合搅拌,然后高温煅烧600~750℃,制取产品LiMn2O4。写出该反应的化学方程式:_____。
-
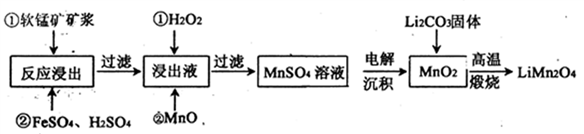
新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如下:
有关物质的溶度积常数
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+= Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为________。
(2)流程中,FeSO4的作用是_______,MnO的作用是_________,当滤液中的pH为6时,滤液中所含铝离子的浓度为___________。
(3)采用下图装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为________;电解产生的MnO2沉积在电极上,该电极反应式为_________。
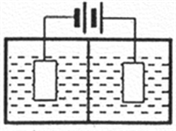
(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出。则Fe2+与矿浆中MnO2反应的离子方程式为__________。
(5)写出高温煅烧生成锰酸锂的化学方程式___________。
-
新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂的流程如图:
已知: lg2=0.3, =8,25℃有关物质的溶度积常数:
=8,25℃有关物质的溶度积常数:
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 5.12×10-33 | 4.0×l0-14 |
(1)已知锂电池放电时正极的电极反应式为:LiMn2O4+e-+Li+ ===Li2Mn2O4,则锰酸锂中锰元素的化合价为____。
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_____,检验还含有Fe2+的方法是______。
(3)“精制”中加入H2O2的量比理论值大的多,其主要原因是______,若所得溶液中锰离子的浓度为1 mol·L-1,则加入氧化锰调节pH的范围为____(当溶液中离子浓度小于10-5 mol·L-1时可以认为沉淀完全)。
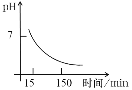
(4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为Mn3O4,若控温氧化时溶液的pH随时间的变化如下图,则15~150 min内滤饼中一定参加反应的成分是______;判断的理由是____(用化学方程式表示)。
(5)写出高温煅烧生成锰酸锂的化学方程式_______。
-
锰酸锂(LiMn2O4)可作为锂离子电池的正极材料。工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如下:
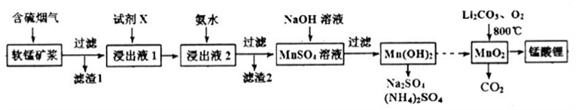
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质。
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
③部分氢氧化物沉淀相关的溶液pH如下表:

(1)已知:
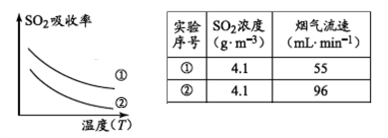
下列措施可提高SO2吸收率的是__________(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是_____________(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是_______________。
(4)锰酸锂可充电电池的总反应式为:Li1-xMnO2+LixC  LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
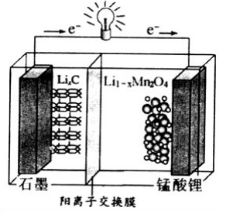
①放电时,电池的正极反应式为__________________
②充电时,若转移1mole-,则石墨电极将增重__________g。
-
锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)为提高含硫烟气中SO2的吸收率,可以采取的措施_____________(举一例)。
(2)滤液1中所含金属阳离子有Mn2+、_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式___________;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)
-
锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)已知:SO2的吸收率与温度及烟气流速的关系如图。
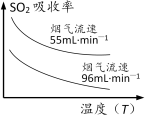
为提高含硫烟气中SO2的吸收率,可以采取的措施________________。
(2)滤液1中所含金属阳离子有Mn2+、_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比为1∶4混合均匀加热制取LiMn2O4。
①升温到515 ℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________。
②升温到566 ℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程发生的化学反应方程式_________________。
③升温到720 ℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出发生的化学反应方程式_________________。
(4)请补充完整由“滤液1”得到“滤液2”和Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)
-
高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由软锰矿浆(主要成分是MnO2)吸收含硫废渣产生的废气制备,工艺如下图所示。
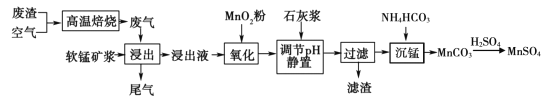
已知:浸出液的pH <2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。请回答下列问题:
(l)高温焙烧前需将矿石研成粉末,其目的是____。
(2)“氧化”中添加适量的MnO2的作用是____(用离子方程式表示);写出“沉锰”的离子方程式____。
(3)下列各组试剂中,能准确测定尾气中SO2含量的是____。(填编号)
a NaOH溶液、酚酞试液
b 稀H2SO4酸化的KMnO4溶液
c 碘水、淀粉溶液
d 氨水、酚酞试液
(4)滤渣的主要成分有____。
(5)若要从MnSO4溶液中得到高纯硫酸锰必须进行的实验操作顺序是____(用字母填空)。
a 过滤洗涤 b 蒸发浓缩 c 冷却结晶 d 干燥
(6)已知: pH =7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10 -6mol/L),需调节溶液pH范围为____
pH =7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10 -6mol/L),需调节溶液pH范围为____
-
2019年诺贝尔化学奖颁发给三位开发锂离子电池的科学家。锂离子电池正极材料是决定其性能的关键.
(1)锰酸锂(LiMn2O4)电池具有原料成本低、合成工艺简单等优点。Li+能量最低的激发态离子的电子排布图为________,该晶体结构中含有Mn4+,基态Mn4+核外价层电子占据的轨道数为__________________个。
(2)磷酸铁锂(LiFePO4)电池安全、充电快、使用寿命长,其中P原子的杂化方式为__________________,阴离子的空间结构为__________________。
(3)三元正极材料 掺杂Al3+可使其性能更优,第四电离能:Mn__________________Al(填“大于”“小于”),原因是__________________。
掺杂Al3+可使其性能更优,第四电离能:Mn__________________Al(填“大于”“小于”),原因是__________________。
(4)铋化锂被认为是很有潜力的正极材料,晶胞结构如图所示。
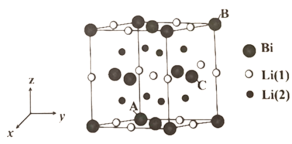
①晶胞可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处。晶体的化学式为__________________,图中铋原子坐标参数:A为(0,0,0), B为(0,1,1),C为__________________。
②若晶胞参数为anm,则铋原子的半径为__________________nm,八面体间隙中的锂原子与四面体间隙中的锂原子之间的最短距离为__________________nm。
-
稀硫酸酸化后的软锰矿(主要成分为MnO2)悬浊液可用于吸收燃煤尾气中的SO2,得到MnSO4, MnSO4可与KMnO4反应制备电池材料MnO2,同时生成H2SO4。下列用来解释事实的方程式不正确的是( )
A.MnO2吸收SO2的反应:
B.MnO2作为碱 性电池正极材料时的放电反应:
性电池正极材料时的放电反应:
C.MnSO4与KMnO4反应制备
D.尾气中的SO2 还可用足量的氨水吸收: