-
2019年7月1日起,上海进入垃圾分类强制时代,随后全国各地也纷纷开始实行垃圾分类。这体现了我国保护环境的决心,而环境保护与化学息息相关,下列有关说法正确的是( )
A.废弃的聚乙烯塑料属于白色垃圾,不可降解,能使溴水褪色
B.可回收的易拉罐中含金属铝,可通过电解氯化铝制取
C.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时均只生成CO2和H2O
D.废旧电池中含有镍、镉等重金属,不可用填埋法处理
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol Na与O2完全反应生成Na2O和Na2O2的混合物,转移电子数为NA,生成物中离子总数为2NA
B.
的NaHSO3溶液中,由水电离的H+数目为0.01NA个
C.32.5 g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5NA
D.反应3H2(g)+N2(g)
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量9.2 kJ时转移电子0.3NA
难度: 中等查看答案及解析
-
某有机化工品R的结构简式如图所示。下列有关R的说法正确的是
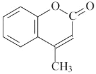
A.R的分子式为C10H10O2
B.苯环上一氯代物有2种
C.R分子中所有原子可共平面
D.R能发生加成、氧化和水解反应
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W在大气中有两种同素异形体且均能支持燃烧,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是( )
A.Y、Z元素的简单氢化物稳定性Y>Z B.ZW2、X2W2都能使品红溶液褪色,且褪色原理相同
C.X、W、Z能形成具有强氧化性的XZW D.X2YW3的水溶液显碱性
难度: 中等查看答案及解析
-
下列设计的实验方案能达到相应实验目的的是( )
选项
实验目的
实验方案
A
探究化学反应的限度
取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
B
探究浓度对化学反应速率的影响
用两支试管各取5mL 0.1mol/L的KMnO4溶液,分别加入2mL 0.1mol/L和 0.2mol/L的H2C2O4(草酸
溶液,记录溶液褪色所需的时间
C
证明乙醇的消去反应有乙烯生成
将含有浓硫酸的乙醇溶液迅速升温至170℃,将产生的气体直接通入酸性KMnO4溶液中
D
验证醋酸钠溶液中存在水解平衡
取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体
其水溶液呈中性
,观察溶液颜色变化
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
新型镁-锂双离子二次电池如图,下列关于该电池的说法不正确的是( )
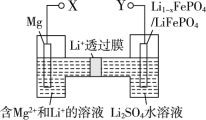
A.放电时,Li+由左向右移动
B.放电时,导线上每通过1 mol e-,左室溶液质量减轻5 g
C.充电时,外加电源的正极与Y相连
D.充电时,阳极上的电极反应式为LiFePO4 -xe-=Li1-xFePO4+xLi+
难度: 困难查看答案及解析
-
如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,根据图示判断,下列说法正确的是( )
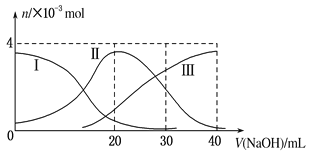
A.H2A在水中的电离方程式是:H2A=H++HA-;HA-
H++A2-
B.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(OH-) >c(H+)
C.当V(NaOH)=40 mL时,溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
难度: 困难查看答案及解析
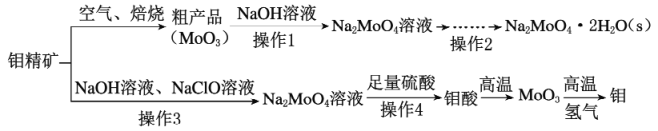
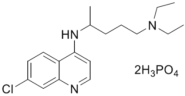
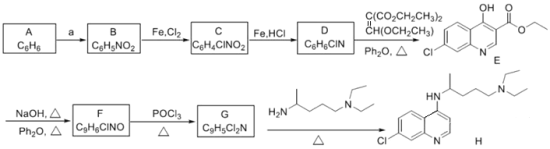
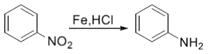
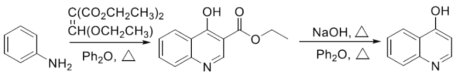
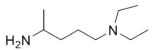
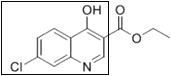 方框中的部分)。
方框中的部分)。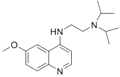 是治疗血吸虫病的药物。参照上述D→H的合成路线,设计一条由4-甲氧基苯氨
是治疗血吸虫病的药物。参照上述D→H的合成路线,设计一条由4-甲氧基苯氨