-
玻璃的出现与使用已有四千多年的历史。下列说法正确的是( )
A.玻璃花纹可以用氢氟酸进行雕刻
B.有机玻璃的主要成分为硅酸钠
C.纯碱和硅单质是制取普通玻璃的主要原料
D.玻璃外观规则,属于晶体,有固定的熔点
难度: 中等查看答案及解析
-
下列实验能达到目的的是( )
选项
目的
实验
A
除去溴苯中的溴
加蒸馏水后振荡、分液
B
验证SO2的漂白性
将SO2通入高锰酸钾溶液中
C
区分葡萄糖溶液和淀粉溶液
往两溶液中分别滴加KI溶液
D
比较浓H2SO4与浓HNO3的氧化性的强弱
常温下,将铜丝分别插入两溶液中
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
甲基丙烯酸(
)是合成橡胶的主要原料。下列说法正确的是( )
A.分子中所有原子共平面
B.与HCl反应生成两种有机物
C.不能使酸性高锰酸钾溶液褪色
D.与乙醇反应生成高分子化合物
难度: 中等查看答案及解析
-
某小组在20℃,101KPa下探究Cl2在蒸馏水和饱和食盐水中的溶解性。如图I、II所示,该小组用两支100mL注射器均吸入40mLCl2,然后分别吸入20mL蒸馏水和饱和食盐水,夹紧止水夹,充分振荡。下列说法正确的是( )
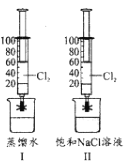
A.图I注射器中c(Cl-)约为0.09mol•L-1
B.图l注射器中n(ClO-)小于图II
C.图II注射器的活塞移动到20mL刻度处
D.图II注射器中存在NaCl(s)
Na+(aq)+Cl-(aq)
难度: 中等查看答案及解析
-
一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是( )

A.WX是共价化合物
B.原子半径:W>Z>Y
C.最高价氧化物对应的水化物的酸性:Q<Y
D.Z和X、Y、W、Q均形成至少两种二元化合物
难度: 中等查看答案及解析
-
科学家研制出一种高性能水系酸碱双液锌一溴二次电池,其总反应为:Zn+2OH-+Br3-
ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
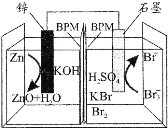
A.放电时,K+向石墨电极迁移
B.放电时,锌电极的电势高于石墨电极
C.充电时,阴极室的pH减小
D.充电时,石墨电极发生反应:Br3--2e-=3Br-
难度: 中等查看答案及解析
-
常温下,在“H2S—HS-—S2-”的水溶液体系中,H2S、HS-、S2-三种微粒的物质的量分数随溶液pH变化(仅用H2S和NaOH调节pH)的关系如图所示。下列说法正确的是
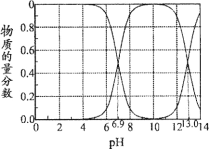
A.Kal(H2S)的数量级为10-6
B.NaHS溶液中,c(Na+)>c(HS-)>c(S2-)>c(H2S)
C.当体系呈中性时,
>
D.加入Na2S沉降废水中的Cu2+,废水的pH对沉降效果没有影响
难度: 困难查看答案及解析
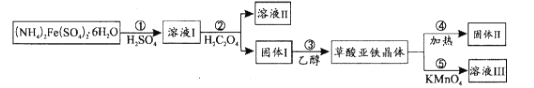

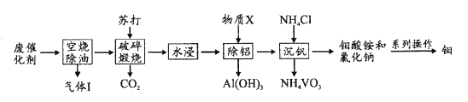
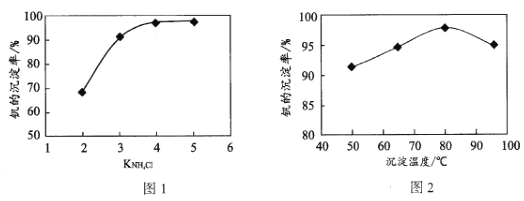
 为催化剂,
为催化剂,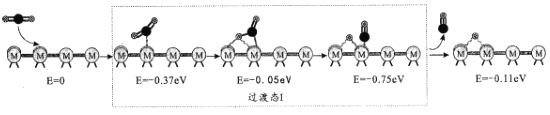

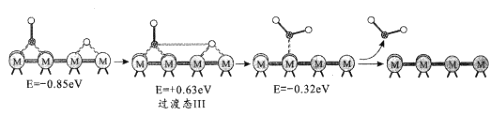

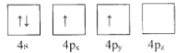 B.
B.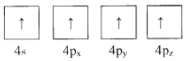
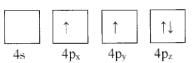 D.
D.


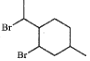 制备的
制备的 合成路线(无机试剂任选)_____。
合成路线(无机试剂任选)_____。