-
对碳原子核外两个未成对电子的描述,正确的是( )
A. 电子云形状不同 B. 自旋方向相同
C. 能量不同 D. 在同一轨道
难度: 简单查看答案及解析
-
下列能源中,蕴藏有限、不能再生的是
A. 氢能 B. 太阳能 C. 地热能 D. 化石燃料
难度: 简单查看答案及解析
-
下列说法正确的是
A.在所有元素中,氟的第一电离能最大
B.处于最低能量的原子叫做基态原子
C.原子半径最小的氢元素的电负性最大
D.最外层电子数为8的都是稀有气体元素的原子
难度: 简单查看答案及解析
-
已知M、N两种元素分别位于s区、p区,下列说法中错误的是
A.基态时,N原子的最外电子层上的电子数一定比M原子的多
B.N元素的电负性不一定比M元素的大
C.由M、N两种元素所形成的化合物中,N一定显负价
D.若M、N原子的电子层数相同,则原子半径:M > N
难度: 简单查看答案及解析
-
已知:2H2(g) +O2(g)=2H2O(g) ΔH =-483.6 kJ·mol−1
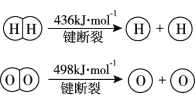
下列说法不正确的是
A.该反应可作为氢氧燃料电池的反应原理
B.破坏1 mol H-O键需要的能量是463.4 kJ
C.H2的燃烧热ΔH<-241.8 kJ·mol−1
D.H2(g)中的H-H键比H2O(g)中的H-O键牢固
难度: 简单查看答案及解析
-
某反应由两步反应A
B
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是
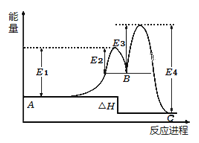
A. 两步反应均为放热反应
B. 整个反应的ΔH=E1-E2+E3-E4
C. 加入催化剂可以改变反应的焓变
D. 三种物质所含能量由高到低依次为:A、B、C
难度: 中等查看答案及解析
-
下列事实能用勒夏特列原理解释的是
A.用排饱和食盐水的方法收集氯气
B.500℃左右比室温更有利于工业合成NH3的反应
C.加入催化剂有利于SO2的氧化反应
D.对2HI(g)
H2(g) + I2(g),减小容器体积,气体颜色变深
难度: 中等查看答案及解析
-
某温度下,可逆反应mA(g) + nB(g) ⇌pC(g) ΔH < 0 的化学平衡常数为K,下列说法正确的是
A.其他条件不变,升高温度,K值增大
B.其他条件不变,恒容条件下,通入稀有气体,正、逆反应速率均增大
C.其他条件不变,减小C(g)的浓度,正反应速率增大,逆反应速率减小
D.其他条件不变,增大压强,活化分子百分数不变,有效碰撞几率增加
难度: 中等查看答案及解析
-
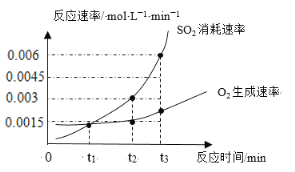
温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g)
CO2(g) + H2(g) ∆H = -41 kJ/mol。数据如下,下列说法不正确的是
容器
甲
乙
反应物
CO
H2O
CO
H2O
起始时物质的量(mol)
1.2
0.6
2.4
1.2
平衡时物质的量(mol)
0.8
0.2
a
b
A.甲容器中,平衡时,反应放出的热量为16.4 kJ
B.T1时,反应的平衡常数K甲 = 1
C.平衡时,乙中CO的浓度是甲中的2倍
D.乙容器中,平衡时CO的转化率约为75%
难度: 中等查看答案及解析
-
滴有酚酞试液的下列溶液,按下列操作后颜色变深的是
A.明矾溶液加热 B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体 D.小苏打溶液中加入少量水
难度: 简单查看答案及解析
-
用0.1000 mol/L的盐酸滴定20.00 mL NaOH溶液,测定其浓度,下列说法正确的是
A.需用NaOH溶液润洗锥形瓶
B.用量筒量取20.00 mL NaOH溶液
C.使用酚酞做指示剂,滴定终点的现象为溶液浅红色褪去,半分钟不变色
D.滴定前,没有除去酸式滴定管中的气泡,滴定后气泡消失,所测浓度会偏小
难度: 中等查看答案及解析
-
下列叙述正确的是
A.常温下由水电离c(H+)=10− 4 mol/L的溶液,有可能是稀盐酸
B.pH相同的NaOH溶液和Na2S溶液加水稀释相同倍数后,Na2S溶液pH较大
C.0.1 mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.Na2CO3溶液中:c(HCO3-)+c(H+)+c(H2CO3)=c(OH-)
难度: 中等查看答案及解析
-
常温下用pH为3的某酸溶液分别与pH均为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是
A.a溶液不可能显中性 B.a溶液不可能显酸性
C.b溶液不可能显中性 D.b溶液不可能显碱性
难度: 简单查看答案及解析
-
2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂电池充电时阳极反应式为:LiFePO4 -xLi+ -xe-→ xFePO4 + (1-x)LiFePO4。放电工作示意图如下图。下列叙述不正确的是
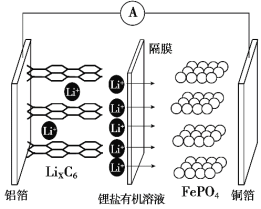
A.放电时,Li+ 通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:FePO4 + xLi+ + xe-→ xLiFePO4 + (1-x)FePO4
D.该电池充放电过程通过Li+ 迁移实现,C、Fe、P元素化合价均不发生变化
难度: 中等查看答案及解析