-
CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。
(1)CO2 催化加氢合成二甲醚的过程中主要发生下列反应:
反应I: CO2(g) + H2(g)  CO(g) + H2O(g) ∆H= + 41.2 kJ·mol−1
CO(g) + H2O(g) ∆H= + 41.2 kJ·mol−1
反应II:2CO2(g) + 6H2(g)  CH3OCH3(g) + 3H2O(g) ∆H = -122.5 kJ·mol−1
CH3OCH3(g) + 3H2O(g) ∆H = -122.5 kJ·mol−1
其中,反应II分以下①、②两步完成,请写出反应①的热化学方程式:①___________
② 2CH3OH(g)  CH3OCH3(g) + H2O(g) ∆H = -23.5 kJ·mol−1
CH3OCH3(g) + H2O(g) ∆H = -23.5 kJ·mol−1
(2)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应式为____________。以该电池为电源,用惰性电极电解饱和食盐水的化学方程式为________。
(3)反应I产生的CO,有人设想按下列反应除去:2CO(g) = 2C(s) + O2(g),已知该反应的∆H>0,简述该设想能否实现的依据_____________。
(4)CO2在自然界循环时可与CaCO3反应,Ksp(CaCO3)=2.8×10−9。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10−5mol·L−1,则生成沉淀所需CaCl2溶液的最小浓度为________。
-
合成气(主要成分为CO、CO2和H2)是重要的化工原料,可利用合成气在催化剂存在下直接制备二甲醚(CH3OCH3)。
己知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
(1)工业上用CO2和H2在一定条件下反应直接制备二甲醚,主反应为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①要使该反应速率和产率都增大,应该采取的措施是__________;若想减少副反应,大幅度提高二甲醚在产物中所占比率的关键因素是__________。
②一定条件下.上述主反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是__________(填标号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的 变小
变小
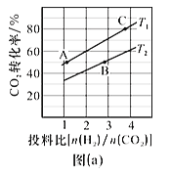
③在某压强下,制备二甲醚的反应在不同温度、不同投料比时CO2的转化率如图(a)所示。T1温度下,将6molCO2和12molH2充入10L的密闭容器中, 5 min后反应达到平衡状态,则0〜5 min内的平均反应速率v(CH3OCH3)=__________;KA、 KB、 KC三者之间的大小关系为___________。
(2)在适当条件下由CO和H2直接制备二甲醚,另一产物为水蒸气。
①该反应的热化学方程式是_______________________________。
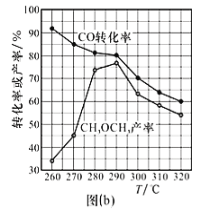
②CO的转化率、二甲醚的产率与反应温度的关系如图(b)所示,请解释290℃后升高温度,CH3OCH3产率逐渐走低的原因可能是________________________________。
-
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应: 甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJ•mol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJ•mol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJ•mol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJ•mol-1
(1)分析二甲醚合成反应(iV)对于CO转化率的影响 。
(2)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响: 。
(3)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是: 。

-
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应(均为可逆反应):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤气变换反应 ③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反应 ④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为________。
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是________。
a.容器中气体平均相对分子质量保持不变
b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为________ ,该温度下,平衡常数K=________;该温度下,向容器中再充入2mol CH3OH(g),对再次达到的平衡状态的判断正确的是________。
a.CH3OH(g)的平衡转化率减小
b.CH3OCH3 (g)的体积分数增大
c.H2O(g)浓度为0.5mol·L-1
d.容器中的压强变为原来的1.25倍
(4)二甲醚—氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚—氧气燃料电池的负极反应为________;消耗2.8L(标准状况)氧气时,理论上流经外电路的电子________mol
-
CO2催化加氢合成CH4的过程中主要发生下列反应:
①CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
CO2(g)+2H2O(g) ΔH1=-802.0kJ·mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
③2CO(g)+O2(g) 2CO2(g) ΔH3=-566.0kJ·mol-1
2CO2(g) ΔH3=-566.0kJ·mol-1
下列有关说法正确的是( )
A.CH4的燃烧热为802.0kJ·mol-1
B.反应②能自发进行的原因是ΔS<0
C.使用催化剂是为了提高CO2加氢时原料的平衡转化率
D.反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)的ΔH=-165.2kJ·mol-1
-
某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚(CH3OCH3)等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示,则在10 min时,改变的外界条件可能是__________________________。

(2)反应③中ΔH3=_____________。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是_________(填代号)。
a.v正>v逆 b.v正<逆 c.v正=v逆 d.无法判断
(3)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。___________

(4)某合成气的主要成分中的一氧化碳,在一定条件下也可用NaOH溶液与CO反应生成甲酸钠(HCOONa),进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L b mol·L-1NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数Ka=_________(用含a和b的代数式表示)。
-
Ⅰ.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) △H<0
CH3OCH3(g)+3H2O(g) △H<0
温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将_________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将_______________。
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)⇌2N2O5(g) △H<0的影响.
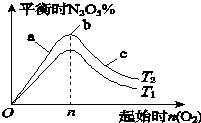
(1)图象中T1和T2的关系是T1_________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是_________(填字母);
(3)若容器体积为1L,n=1mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数K=_________.
-
Ⅰ.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)ΔH<0。温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将_____________________。
CH3OCH3(g)+3H2O(g)ΔH<0。温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将_____________________。
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g) 2N2O5(g) ΔH<0的影响。
2N2O5(g) ΔH<0的影响。
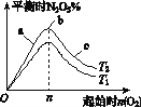
(1)图像中T1和T2的关系是T1________T2(填“>”、“<”或“=”)。
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是________(填字母)。
-
I.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)  CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0
温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将________;
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)  2N2O5(g) ΔH<0的影响。
2N2O5(g) ΔH<0的影响。
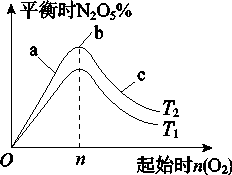
(1)图像中T1和T2的关系是T1________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是________(填字母);
(3)若起始时NO2是4mol,容器体积为1 L,n=1 mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数为_________________。
-
I.工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g) ΔH <0 温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将____________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将____________;
CH3OCH3(g)+3H2O(g) ΔH <0 温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将____________(填“变大”、“变小”或“不变”,下同),混合气体的平均相对分子质量将____________;
Ⅱ.某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)  2N2O5(g) ΔH <0的影响。
2N2O5(g) ΔH <0的影响。
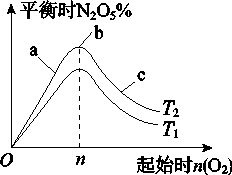
(1)图像中T1和T2的关系是T1________T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是________(填字母);
(3)若起始时NO2是4mol,容器体积为1 L,n=1 mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数为_________________。
CO(g) + H2O(g) ∆H= + 41.2 kJ·mol−1
CH3OCH3(g) + 3H2O(g) ∆H = -122.5 kJ·mol−1
CH3OCH3(g) + H2O(g) ∆H = -23.5 kJ·mol−1








