-
向等物质的量浓度的NaOH和Na2CO3的混合液中加入稀盐酸。下列离子方程式与事实不相符的是
A.OH-+CO32-+2H+=HCO3-+H2O B.2OH-+CO32-+3H+=HCO3-+2H2O
C.2OH-+CO32-+4H+=CO2↑+2H2O D.OH-+CO32-+3H+=CO2↑+2H2O
难度: 中等查看答案及解析
-
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g) ⇌ 2N2O5(g);已知该反应的平衡常数:K300℃>K350℃,且体系中n(NO2)(单位:mol)随时间变化如下表:
时间(s)
0
500
1000
1500
t1℃
20
13.96
10.08
10.08
t2℃
20
a
b
c
下列说法一定正确的是
A.正反应为吸热反应
B.如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1000s至1500s之间
D.如果t2℃>t1℃,那么b>10.08
难度: 中等查看答案及解析
-
短周期同周期元素A、B、C、D的核电荷数依次增大,其简单离子一定都能破坏水的电离平衡的是
A.A+、B2+ B.C2-、D- C.A+、D- D.B3+、C2-
难度: 中等查看答案及解析
-
原子的种类决定于
A.质子数 B.质子数和电子数
C.质子数和质量数 D.中子数
难度: 简单查看答案及解析
-
下列有关化学用语能表示甲烷的分子组成,但不能反映其分子空间构型的是

A.结构示意图 B.电子式 C.球棍模型 D.比例模型
难度: 简单查看答案及解析
-
下列说法正确的是
A.离子化合物中一定含有金属元素 B.原子晶体熔化要破坏共价键
C.构成分子晶体的微粒中一定含有共价键 D.只有离子化合物中才存在离子
难度: 简单查看答案及解析
-
在苯酚钠溶液中通入少量二氧化碳,发生反应:C6H5ONa+ CO2+ H2O→ C6H5OH+ NaHCO3,该反应证明苯酚钠的碱性强于
A.苯酚 B.碳酸钠 C.碳酸氢钠 D.氢氧化钠
难度: 简单查看答案及解析
-
不能说明氯的非金属性比溴强的事实是
A.共用电子对偏移程度:H-Cl > H-Br B.酸性:HClO4 > HBrO4
C.热稳定性:HCl > HBr D.酸性:HCl <HBr
难度: 简单查看答案及解析
-
为了使Na2S溶液中
的比值变小,可适量加入(或通入)的物质是
A.H2S气体 B.NaOH固体 C.HCl气体 D.KOH固体
难度: 简单查看答案及解析
-
在一定条件下,HA溶液存在电离平衡:HA
H++A--Q。下列说法正确的是
A.稀释溶液,HA电离平衡常数增大 B.升高温度,HA电离程度增大
C.加入NaA固体,平衡朝正反应方向移动 D.加入NaOH固体,溶液pH减小
难度: 简单查看答案及解析
-
有关下图的说法正确的是
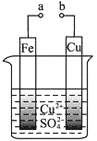
A.构成原电池时Cu极反应为: Cu﹣2e-=Cu2+
B.构成原电池时溶液中SO42- 移向Cu极
C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极
D.形成电解池,Cu电极不可能溶解
难度: 中等查看答案及解析
-
已知碳酸、亚硫酸常温时的电离平衡常数如下表:
酸
电离常数
碳酸
Ki1=4×10-7 Ki2=5.6×10-11
亚硫酸
Ki1=1.54×10-2 Ki2=1.02×10-7
则溶液中不能大量共存的离子组合是
A.SO32-、HCO3- B.HSO3-、CO32- C.SO32-、CO32- D.HSO3-、HCO3-
难度: 中等查看答案及解析
-
已知,还原性I->Fe2+ >Br-。向FeI2和FeBr2物质的量之比为1:1的混合溶液中逐滴滴入氯水,下列离子反应不可能发生的是
A.2Fe2+ + 4I-+ 3Cl2 → 2Fe3+ + 2I2 + 6Cl-
B.2Fe2+ + 2I-+ 2Cl2 → 2Fe3+ + I2 + 4Cl-
C.2Fe2+ + 2I-+ 2Br-+3Cl2 → 2Fe3+ + I2 + Br2 + 6Cl-
D.2Fe2+ + 4I-+ 4Br-+ 5Cl2 → 2Fe3+ + 2I2 + 2Br2 + 10Cl-
难度: 简单查看答案及解析
-
将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气
B.反应后溶液中的Cl-数目为:
C.NA可表示为:
D.反应后溶液中的H+数目为:bc-2d
难度: 简单查看答案及解析
-
下列操作,无法实现实验目的的是
A.
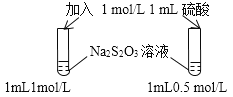 目的:浓度对化学反应速率的影响
目的:浓度对化学反应速率的影响B.
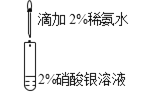 目的:配制银氨溶液
目的:配制银氨溶液C.
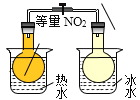 目的:温度对化学平衡的影响
目的:温度对化学平衡的影响D.
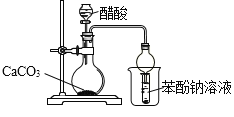 目的:探究醋酸、碳酸、苯酚的酸性强弱
目的:探究醋酸、碳酸、苯酚的酸性强弱难度: 简单查看答案及解析
-
已知25℃时溶解度:AgCl> AgI,若在5 mL含有KCl和KI各为0.01mol/L的溶液中,加入8 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) D.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项错误的是
序号
反应物
产物
①
KMnO4 、H2O2 、H2SO4
K2SO4 、MnSO4
②
Cl2 、FeBr2
FeCl3 、FeBr3
③
MnO4-
Cl2 、Mn2+
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2 与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成1mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
难度: 简单查看答案及解析
-
25 ℃时加水稀释10 mL pH=11的氨水,下列判断不正确的是( )
A.原氨水的浓度大于10-3mol·L-1
B.溶液中c(NH4+)/c(NH3·H2O)增大
C.氨水的电离程度增大,溶液中所有离子的浓度均减小
D.再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7
难度: 中等查看答案及解析
-
反应C(s)+CO2(g)
2CO(g)在恒容容器、一定温度下达到平衡,再充入CO2,达到新的平衡时(温度不变),与原平衡比,以下正确的是
A.平衡向正反应方向移动 B.混合气体的平均摩尔质量增大
C.CO2的转化率增大 D.正反应速率增大逆反应速率减小
难度: 中等查看答案及解析
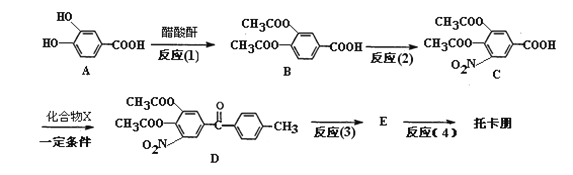
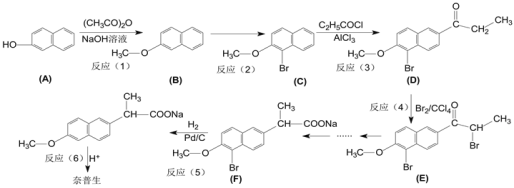
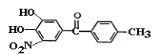 )是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
)是一种治疗帕金森氏病的药物。如图是其中的一种合成路线: