-
碳形成的化合物种类繁多,硅是构成地壳岩石的主要元素。碳在自然界有两种稳定的同位素,有关数据如下表:
同位素
相对原子质量
丰度(原子分数)
12C
12(整数,相对原子质量的基准)
0.9893
13C
13.003354826
0.0107
请列出碳元素近似相对原子质量的计算式_____________________________________。
(1)Si原子的14个电子排布在_______个能级上;与硅元素同周期、其原子核外有2个未成对电子的元素的最外层电子排布式为_____________。
(2)SiO2用途广泛,以下叙述错误的是______________。
a.SiO2是二氧化硅的分子式 b.SiO2中1个Si原子结合4个O原子
c.SiO2是酸性氧化物 d.SiO2熔沸点较高,属于原子晶体
(3)通常状况下,SiF4呈气态。以下叙述正确的是___________。
a.Si原子难以形成Si4+ b.SiF4是有极性键的非极性分子
c.固态SiF4是原子晶体 d.相同压强时,SiF4的沸点高于SiCl4
(4)Fe3O4可以写成FeO•Fe2O3,也可写成盐的形式:Fe[Fe2O4]。Pb3O4中含+2价的Pb和+4价的Pb,请将Pb3O4写成两种氧化物的形式___________,写成盐的形式__________。
(5)Pb的+2价化合物稳定,+4价的Pb能氧化浓盐酸生成Cl2。写出Pb3O4与盐酸反应的化学方程式____________________________________________。
高三化学综合题中等难度题查看答案及解析
-
(9分)4种短周期元素相对位置如下表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) = 1.3×10-3 mol·L-1。则HR
H++R-的电离平衡常数Ka= (保留一位小数)。
高三化学填空题中等难度题查看答案及解析
-
短周期元素X、Y、Z、W在周期表中相对位置如下图所示,Y元素在地壳中的含量最高。下列说法正确的是
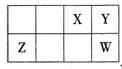
A.原子半径:Z<Y<W
B.最简单气态氢化物的热稳定性:Y<W
C.含X的化合物形成的溶液一定呈酸性
D.Y的最简单阴离子和Z的最简单阳离子核外电子数相同
高三化学选择题中等难度题查看答案及解析
-
铯(Cs)在自然界中只有一种稳定同位素
Cs,核泄漏事故中会产生人工放射性同位素
Cs、
Cs。下列有关说法正确的是
A.铯元素的相对原子质量约为133 B.
Cs、
Cs的性质相同
C.
Cs的电子数为79 D.
Cs、
Cs互为同素异形体
高三化学单选题中等难度题查看答案及解析
-
下列有关硅的叙述中,正确的是
A.工业上通常以SiO2为原料,用氧化剂与其反应制备单质硅
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一 位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是重要的半导体材料
高三化学单选题中等难度题查看答案及解析
-
下列有关硅的叙述中,正确的是
A.工业上通常以SiO2为原料,用氧化剂与其反应制备单质硅
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位
C.硅的化学性质不活泼,在自然界中可以以游离态存在
D.硅在电子工业中,是重要的半导体材料
高三化学选择题中等难度题查看答案及解析
-
有X、Y、Z三种原子序数逐渐增大的主族元素,它们分别处于不同短周期,其中Y是自然界中形成化合物种类最多的元素,Z元素在地壳中的含量是同周期主族元素中最高的。则下列说法错误的是
A. X与其它元素之间只能形成共价键
B. Z元素的最高价氧化物是玻璃的主要成分,其常温下就能与强碱发生反应
C. 非金属性Y强于Z
D. 三种元素中X的原子半径最小
高三化学选择题中等难度题查看答案及解析
-
六种短周期元素A、B、C、D、E、F的原子序数依次增大,只有E是金属元素,其一种核素的质量数为28,中子数比质子数多2,B是自然界中形成物质种类最多的元素,D是地壳中含量最多的元素;A、C、E、F原子最外层电子数为互不相等的奇数,且A、C、F原子最外层电子数之和恰好等于E元素的核电荷数,A与F最高化合价之和为8,下列说法正确的是
A. A、C、D三种元素形成的化合物一定是共价化合物
B. 工业上常用电解E与F形成的化合物的方法制取单质E
C. 原子半径由大到小的顺序:D>C>B>A
D. B、C、F元素最高价氧化物水化物酸性最强的是F
高三化学选择题困难题查看答案及解析
-
有A、B、C、D、E五种短周期元素,A是地壳中含量最多的元素,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C是非金属性最强的元素,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个。下列说法正确的是
A.离子半径:D+>C-
B.EA2是光导纤维的主要成分
C.A和B可以形成原子个数比1∶1的化合物
D.以上元素中形成的最高价氧化物对应的水化物酸性最强的是C
高三化学选择题困难题查看答案及解析
-
有A、B、C、D、E五种短周期元素,A是地壳中含量最多的元素,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C是非金属性最强的元素,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个。下列说法正确的是
A.D元素的金属性在短周期元素中最强
B.E单质常用作半导体材料和光导纤维
C.A和B只能形成原子个数比1︰2的化合物
D.以上元素中形成的最高价氧化物对应的水化物酸性最强的是C
高三化学选择题困难题查看答案及解析