-
常温下,往饱和石灰水中加入一定量的生石灰,一段时间后恢复到原温度,以下叙述错误的是
A.有溶质析出 B.溶液中Ca2+的数目不变
C.溶剂的质量减小 D.溶液的pH不变
难度: 简单查看答案及解析
-
结构片段为…―CH2―CH=CH―CH2―…的高分子化合物的单体是
A.乙烯 B.乙炔 C.正丁烯 D.1,3-丁二烯
难度: 简单查看答案及解析
-
化学与人类生活密切相关。下列说法正确的是
A.矿物油和植物油都可以通过石油分馏来获取
B.硫酸亚铁可作补血剂组成成分
C.蛋白质的水解产物都是α-氨基酸
D.造成PM2.5的直接原因是土壤沙漠化
难度: 简单查看答案及解析
-
下列化学用语使用正确是
A.氧原子能量最高的电子的电子云图:
B.35Cl与37Cl互为同素异形体
C.CH4分子的比例模型:
D.
的命名:1,3,4-三甲苯
难度: 中等查看答案及解析
-
与溴水反应不会产生沉淀的是
A.乙烯 B.AgNO3溶液 C.H2S D.苯酚
难度: 中等查看答案及解析
-
2015年2月,科学家首次观测到化学键的形成。化学键不存在于
A.原子与原子之间 B.分子与分子之间
C.离子与离子之间 D.离子与电子之间
难度: 简单查看答案及解析
-
下列事实能用元素周期律解释的是
A.沸点:H2O>H2Se>H2S B.酸性:H2SO4>H2CO3>HClO
C.硬度:I2>Br2>Cl2 D.碱性:KOH>NaOH>Al(OH)3
难度: 简单查看答案及解析
-
下图可设计成多种用途的电化学装置。下列分析正确的是
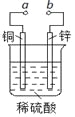
A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动
B.将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法
C.当a和b用导线连接时,铜片上发生的反应为:2H++2e-=H2↑
D.a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体
难度: 中等查看答案及解析
-
液态氨中可电离出极少量的NH2-和NH4+。下列说法正确的是
A.NH3属于离子化合物 B.常温下,液氨的电离平衡常数为10-14
C.液态氨与氨水的组成相同 D.液氨中的微粒含相同的电子数
难度: 中等查看答案及解析
-
将燃着的H2S不断通入盛有一定量O2的集气瓶中。当火焰熄灭后继续通入H2S,发生的主要反应是
A.2H2S+O2=2S+2H2O B.2H2S+3O2=2SO2+2H2O
C.2H2S+SO2=3S+2H2O D.2SO2+O2=2SO3
难度: 简单查看答案及解析
-
如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )
选项
X
Y
Z
A
食盐、浓硫酸
HCl
碱石灰
B
CaO、浓氨水
NH3
无水CaCl2
C
Cu、浓硝酸
NO2
碱石灰
D
电石、食盐水
C2H2
含溴水的棉花
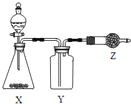
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列工业生产过程中涉及到反应热再利用的是
A.接触法制硫酸 B.联合法制纯碱
C.铁矿石炼铁 D.石油的裂化和裂解
难度: 简单查看答案及解析
-
在催化剂、400℃时可实现氯的循环利用,下图是其能量关系图下列分析正确的是
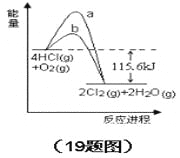
A.曲线a是使用了催化剂的能量变化曲线
B.反应物的总键能高于生成物的总键能
C.反应的热化学方程式为:4HCl(g)+O2(g) = 2Cl2+2H2O(g)△H=-115.6 kJ
D.若反应生成2mol液态水,放出的热量高于115.6kJ
难度: 中等查看答案及解析
-
某未知溶液可能含Na+、NH4+、Fe2+、I-、Cl-、CO32-、SO32-。将该溶液加少量新制氯水,溶液变黄色。再向上述反应后溶液中加入BaCl2溶液或淀粉溶液,均无明显现象。下列推断合理的是
A.一定存在Fe2+、Na+、Cl- B.一定不存在I-、SO32-
C.一定呈碱性 D.一定存在NH4+
难度: 中等查看答案及解析
-
模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示。下列说法正确的是
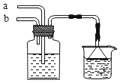
A.a通入适量的CO2,b通入足量的NH3,纳米材料为Ca(HCO3)2
B.a通入足量的NH3,b通入适量的CO2,纳米材料为Ca(HCO3)2
C.a通入适量的CO2,b通入足量的NH3,纳米材料为CaCO3
D.a通入少量的NH3,b通入足量的CO2,纳米材料为CaCO3
难度: 简单查看答案及解析
-
反应2NO2(g)
N2O4(g) + 57 kJ,若保持气体总质量不变。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
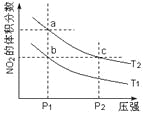
A.a、c两点气体的颜色:a浅,c深
B.a、c两点气体的平均相对分子质量:a>c
C.b、c两点的平衡常数:Kb=Kc
D.状态a通过升高温度可变成状态b
难度: 中等查看答案及解析
-
在高温高压的水溶液中,AuS-与Fe2+发生反应沉积出磁铁矿(主要成分Fe3O4)和金矿(含Au),并伴有H2S气体生成。对于该反应的说法一定正确的是
A.氧化剂和还原剂的物质的量之比2:3
B.AuS-既作氧化剂又作还原剂
C.每生成2.24 L气体,转移电子数为0.1mol
D.反应后溶液的pH值降低
难度: 中等查看答案及解析
-
25℃时,NH3·H2O和CH3COOH的电离常数K相等。下列说法正确的是
A.常温下,CH3COONH4溶液的pH=7,与纯水中H2O的电离程度相同
B.向CH3COONH4溶液加入CH3COONa固体时,c(NH4+)、c(CH3COO-)均会增大
C.常温下,等浓度的NH4Cl和CH3COONa两溶液的pH之和为14
D.等温等浓度的氨水和醋酸两溶液加水稀释到相同体积,溶液pH的变化值一定相同
难度: 中等查看答案及解析
-
向含1 mol NaOH、2 mol NaAl(OH)4、1 mol Ba(OH)2的混合液中加入稀硫酸充分反应,加入溶质H2SO4的量和生成沉淀的量的关系正确的是
选项
A
B
C
D
n(H2SO4)/mol
2
3
4
5
n(沉淀) /mol
2
3
2
1.5
A.A B.B C.C D.D
难度: 中等查看答案及解析
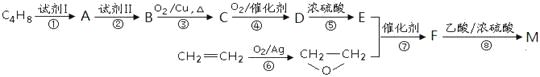
 是锂电池正负极之间锂离子迁移的介质。由烃C4H8合成M的合成路线如下:
是锂电池正负极之间锂离子迁移的介质。由烃C4H8合成M的合成路线如下: