-
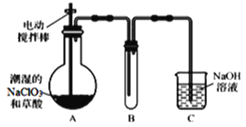
2019年12月以来,我国部分地区突发的新冠病毒肺炎威胁着人们的身体健康。下列有关说法正确的是
A.新型冠状病毒由C、H、O三种元素组成
B.口罩中间的熔喷布具有核心作用,其主要原料为聚丙烯,属于有机高分子材料
C.过氧化氢、乙醇、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的
D.“84”消毒液是以NaClO为主要有效成分的消毒液,为了提升消毒效果,可以与洁厕灵(主要成分为盐酸)混合使用
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-===2Fe2++I2+3H2O
B.0.1 mol·L-1 NH4Al(SO4)2溶液与0.2 mol·L-1 Ba(OH)2溶液等体积混合:Al3++2SO
+2Ba2++4OH-=2BaSO4↓+AlO
+2H2O
C.向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO
难度: 中等查看答案及解析
-
中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是
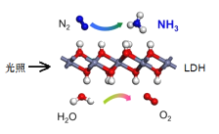
A.该过程中H2O被还原生成氧气
B.该过程中涉及极性键和非极性键的断裂与生成
C.基于合成NH3的过程属于氮的固定
D.该过程的化学方程式为:2N2+6H2O
4NH3+3O2
难度: 中等查看答案及解析
-
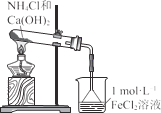
高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
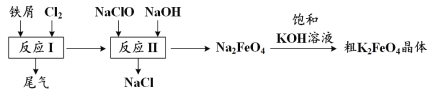
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大。W的气态氢化物遇湿润的红色石蕊试纸变蓝色,X是地壳中含量最高的元素,Y在同周期主族元素中原子半径最大,Z与Y形成的化合物的化学式为YZ。下列说法不正确的是
A.W在元素周期表中的位置是第二周期VA族
B.用电子式表示的形成过程为:
C.同主族中Z的气态氢化物稳定性最强
D.X与Y形成的两种常见的化合物中,阳离子和阴离子的个数比均为2:1
难度: 中等查看答案及解析
-
下列实验现象预测正确的是
A
B
C
D
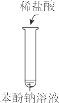
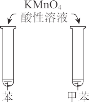
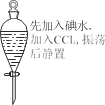
烧杯中产生白色沉淀,一段时间后沉淀无明显变化
加盐酸出现白色浑浊,加热变澄清
KMnO4 酸性溶液在苯和甲苯中均褪色
液体分层,下层呈
无色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
向某密闭容器中充入NO2,发生反应2NO2(g)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃
27
35
49
70
NO2%
20
25
40
66
N2O4%
80
75
60
34
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大
难度: 中等查看答案及解析
-
下列关于有机物的说法,正确的是( )
A.由甲烷在纯氧中完全燃烧只生成CO2和H2O说明甲烷不含氧元素
B.
最多有16个原子共平面
C.油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
难度: 简单查看答案及解析
-
硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号
Ⅰ
Ⅱ
实验
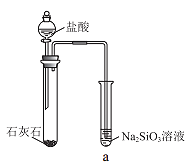
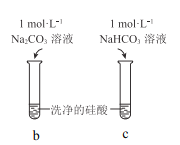
现象
a 中产生凝胶状沉淀
b 中凝胶状沉淀溶解,c 中无明显变化
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓
难度: 困难查看答案及解析
-
Fe3O4中含有Fe2+、Fe3+,分别表示为 Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用 H2消除酸性废水中的致癌物 NO2-,其反应过程示意图如图所示,下列说法不正确的是
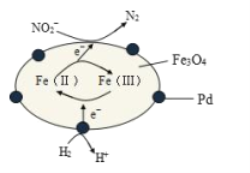
A.用该法处理后水体的 pH降低
B.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被 Fe(Ⅱ)还原为 N2
D.Pd 上发生的电极反应为:H2- 2e-== 2H+
难度: 中等查看答案及解析
-
羟胺的电离方程式为:NH2OH+H2O
NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
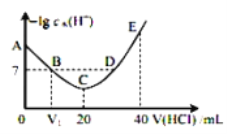
A.图中V1<10
B.A点对应溶液的pH=9.5
C.A、B、C、D四点中酸性最强的点为D点
D.E点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
难度: 困难查看答案及解析
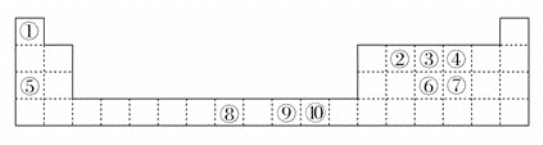
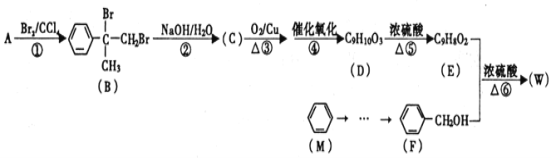
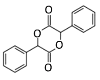 的合成路线(无机试剂任选)_________。
的合成路线(无机试剂任选)_________。