-
下列说法正确的是
A.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
B.高炉、接触室和吸收塔是工业上接触法制硫酸的主要设备
C.肼、甲醇等形成燃料电池放出的热量远高于其直接燃烧放出的热量
D.利用外接直流电源保护铁质建筑物,属于牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
下列说法正确的是
A.
与
互为同位素
B.O2和O3互为同素异形体,两者之间不能相互转化
C.乙醇和甲醚互为同分异构体,可用金属钠鉴别
D.
的一氯代物只有2种(不考虑立体异构)
难度: 中等查看答案及解析
-
下列说法正确的是
A.取少量卤代烃加NaOH水溶液共热,冷却,再加
溶液可检验卤素原子
B.检测NaClO、
等具有强氧化性物质溶液的pH时,最好选用pH试纸
C.将铂丝放在稀硫酸中洗涤并灼烧后,再蘸取待检物进行焰色反应
D.若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗
难度: 简单查看答案及解析
-
为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,
甲基
中含有的中子数为
B.将
溶于稀氨水中,所得溶液呈中性,则溶液中
的数目为
C.
和
在催化剂和加热条件下充分反应生成NO的分子数为
D.常温下,
的
溶液中,发生电离的水分子数为
难度: 中等查看答案及解析
-
下列方程式书写正确的是
A.溴乙烷发生消去反应:
B.向
溶液中加入过量氨水:
C.向
溶液中加入过量
溶液:
D.向含
和KOH均为0.1 mol的混合溶液中通人标准状况下4.48 L
气体:
难度: 简单查看答案及解析
-
物质的性质决定其用途。下列说法正确的是
A.石英坩埚耐高温,可用于加热熔化烧碱、纯碱等固体
B.熟石灰具有碱性,可用于改良酸性过强的土壤
C.浓硝酸具有酸性,可用于除去铝表面的氧化膜
D.浓硫酸具有吸水性,可用于干燥HI、
等气体
难度: 简单查看答案及解析
-
下列说法正确的是
A.常温下,将
的醋酸溶液稀释到原体积的10倍后,溶液的
B.常温下,若NaHA溶液的
,则
是弱酸
C.用盐酸标准溶液滴定氨水至中性时,
未被完全中和
D.
时
溶液的
大于
时NaCl溶液的
难度: 简单查看答案及解析
-
寿山石
是我国四大印章石之首,被称为国石。X,Y,M,N是原子序数依次增大的短周期元素,M元素是地壳中含量最高的金属元素,N元素的单质常用来制造太阳能电池,
和
含有相同的电子数。下列说法正确的是
A.原子半径:
B.简单氢化物的稳定性:
C.第82号元素与M位于同一主族
D.X和M形成的化合物溶于水显酸性
难度: 简单查看答案及解析
-
下列说法正确的是
A.冰的密度小于水,是因为冰中水分子的氢键导致分子间出现较大空隙
B.碘晶体是分子晶体,加热升华过程中只需克服原子间作用力
C.某物质在熔融态时能导电,则该物质一定是离子化合物
D.在
、
晶体中,阳离子与阴离子个数比均为
难度: 简单查看答案及解析
-
已知:
 根据以上热化学方程式,下列判断 不 正 确的是
根据以上热化学方程式,下列判断 不 正 确的是
A.上图可表示由CO生成
的反应过程和能量关系
B.CO的燃烧热
C.

D.
与
反应放出
热量时,电子转移数为
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.乙二醇通过消去反应可制得
B.化合物
的所有原子可能处在同一平面上
C.按系统命名法,化合物
的名称是2,2-二甲基-5-乙基己烷
D.甲醛与氨气制备乌洛托品(
 )的最佳配比:n(NH3):n(HCHO)=2:3
)的最佳配比:n(NH3):n(HCHO)=2:3难度: 中等查看答案及解析
-
在体积可变的恒温密闭容器中按
充入
和
,发生反应:
,在t1时刻达到平衡状态I;在t2时刻向容器中充入一定量的
,t3时刻达到平衡状态Ⅱ。下列说法正确的是
A.t1时刻达到平衡时,v(N2)=3v(H2)
B.t1时刻达到平衡时反应放出的热量小于Q kJ
C.达到平衡时,
的体积分数:
D.
过程中,v(逆)随时间变化如图所示
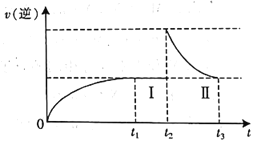
难度: 简单查看答案及解析
-
一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
难度: 困难查看答案及解析
-
常温时,
的
和
的
两种酸溶液,起始时的体积均为
,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是

A.在
时,
溶液满足
B.当稀释至pH均为3时,溶液中
C.稀释前分别用
的NaOH溶液中和,消耗的NaOH溶液体积:
D.常温下,浓度均为
的
和
溶液的
难度: 简单查看答案及解析
-
当实验出现某种现象时,即可判定该步实验操作已完成。下列实验中出现结束该步操作的现象正确的是
A.“镀锌铁皮锌镀层厚度的测定”:铁皮在稀硫酸溶液中不再产生气泡
B.“食醋总酸含量的测定”:滴入NaOH标准溶液,锥形瓶内溶液恰好呈浅红色
C.“乙酸乙酯碱性条件下水解”:NaOH溶液上层的油层消失
D.“硫酸亚铁铵的制备”:蒸发
和
混合溶液,出现大量晶体
难度: 简单查看答案及解析
-
铝灰是铝加工行业的废渣,可能含有Al、
、KCl、FeO、
、MgO、
、
中的若干种。为了确认其成分,某同学依次进行了以下实验:
①将过量的稀盐酸加入铝灰中,充分反应后过滤得到溶液甲和固体乙;
②取少量溶液甲滴加
溶液,生成白色沉淀;
③取少量溶液甲滴加KSCN溶液,溶液变成血红色;
④取少量溶液甲加入过量NaOH溶液,置于空气中充分反应后,经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁。
根据以上实验现象或数据,该同学得出的结论正确的是
A.根据①可推出铝灰中一定含有
B.根据②可推出铝灰中一定含有KCl
C.根据③可推出铝灰中一定含有
D.根据④可推出固体丙中一定不含MgO
难度: 中等查看答案及解析
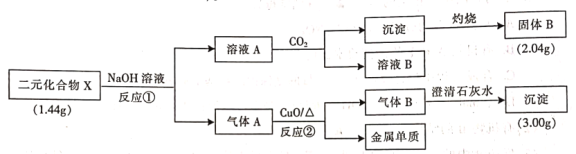
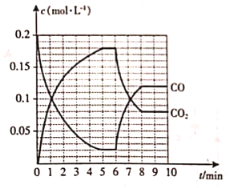

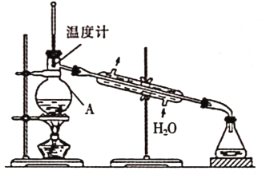
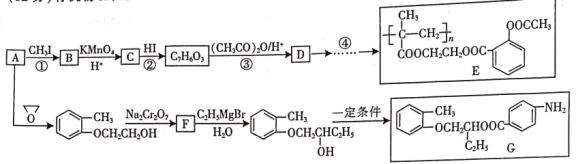
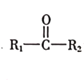

 (R表示烃基,
(R表示烃基, 的合成路线__________(提供
的合成路线__________(提供