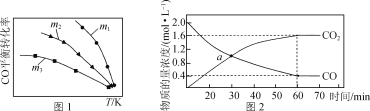
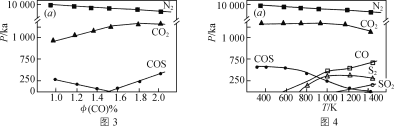
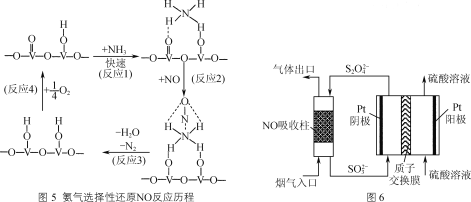
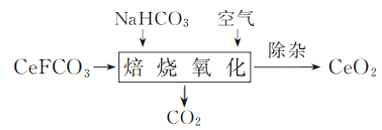
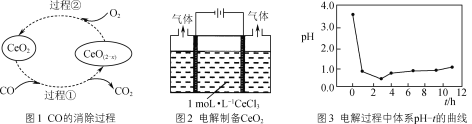
-
党的十九届四中全会明确指出“促进人与自然和谐共生”。下列有关做法不正确的是
A.将废旧电池集中深埋,防止重金属污染 B.提高车用燃油、燃气品质,减少大气污染
C.推广使用高效、低毒农药,减轻水体污染 D.使用可降解聚二氧化碳塑料,减少白色污染
难度: 中等查看答案及解析
-
乙炔气经CaCl2等净化后,在氮气氛中可催化聚合为聚乙炔。下列有关表示正确的是
A.质子数与中子数均为20的钙原子:
Ca B.Cl-的结构示意图:
C.CaCl2的电子式:
D.聚乙炔的结构简式:
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A.FeCl3溶液显酸性,可用于蚀刻印刷电路板
B.NaClO溶液显碱性,可用于杀菌、消毒
C.Al2O3、SiO2熔点高、硬度大,可用于制造坩埚
D.Al(OH)3能与NaOH溶液反应,可用于治疗胃酸过多
难度: 中等查看答案及解析
-
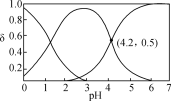
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液:Na+、Ba2+、NO3-、OH-
B.0.1 mol·L-1NaAlO2溶液:K+、OH-、Cl-、NO3-
C.常温下,
=1.0×1012的溶液:Fe2+、Mg2+、NO3-、Cl-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO32-、S2-、Cl-
难度: 中等查看答案及解析
-
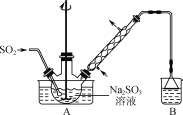
下列制取SO2、验证其性质的装置(尾气处理装置已省略)和原理不能达到实验目的的是( )
A.
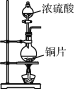 制取SO2 B.
制取SO2 B. 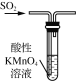 验证漂白性
验证漂白性C.
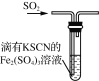 验证还原性 D.
验证还原性 D. 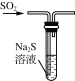 验证氧化性
验证氧化性难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子核外最外层电子数是其电子层数的3倍,Y是短周期中金属性最强的元素,Z位于元素周期表ⅢA族,W与X位于同一主族。下列说法正确的是
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.W的简单气态氢化物的热稳定性比X的强
C.由X、Y组成的化合物中均不含共价键
D.Y、Z、W三种元素的最高价氧化物对应的水化物都能相互发生反应
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.Fe3O4与HI溶液反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
B.NaHSO4溶液和Ba(OH)2溶液混合使溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.Cl2与热的NaOH溶液反应制取NaClO3:2Cl2+6OH-===3Cl-+ClO3-+3H2O
D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3===2FFeO42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
给定条件下,下列选项中所示的物质间转化均能一步实现的组合是
A.SiO2(s)
SiCl4(g)
Si(s)
B.Fe3O4(s)
Fe(s)
FeCl2(s)
C.AgNO3(aq)
[Ag(NH3)2]+
Ag(s)
D.Al2O3(s)
NaAlO2(aq)
Al(OH)3(s)
难度: 中等查看答案及解析
-
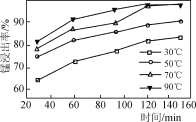
一种电化学“大气固碳”电池工作原理如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是
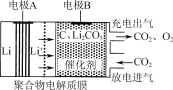
A.该电池放电时的正极反应为2Li-2e-+CO32-===Li2CO2
B.该电池既可选用含水电解液,也可选无水电解液
C.充电时阳极发生的反应为C+2Li2CO3-4e-===3CO2+4Li+
D.该电池每放、充4 mol电子一次,理论上能固定1 mol CO2
难度: 中等查看答案及解析
-
下列说法说法正确的是
A.外接电源保护水中钢闸门时,应将钢闸门与电源的正极相连
B.向Na2CO3溶液中加入少量BaCl2固体,CO32-水解程度增大,溶液的pH减小
C.如图表示常温下稀释pH=11的NaOH溶液和氨水时溶液pH的变化,曲线Ⅱ表示氨水
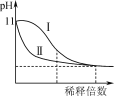
D.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
难度: 中等查看答案及解析
-
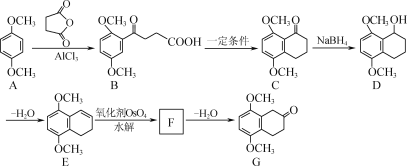
亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
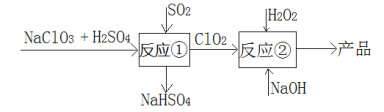
下列说法错误的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.若反应①通过原电池来实现,则ClO2是正极产物
C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于H2O2
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
测定同温同浓度的Na2CO3和Na2SO3溶液的pH,Na2CO3的pH大于Na2SO3溶液
S的非金属性比C强
B
向Fe(NO3)3溶液中加入铁粉,充分振荡,滴加少量盐酸酸化后再滴入1滴KSCN溶液,溶液变红
原Fe(NO3)3溶液中Fe3+只有部分被Fe还原
C
向1溴丙烷中加入KOH溶液,加热、振荡,然后取少量溶液滴入AgNO3溶液,出现棕黑色沉淀
1溴丙烷中混有杂质
D
向1 mL 0.1 mol·L-1 MgSO4溶液中,滴入2滴0.1 mol·L-1 NaOH溶液,产生白色沉淀,再滴入2滴0.1 mol·L-1 CuSO4溶液,白色沉淀逐渐变为蓝色
Ksp[Mg(OH)2] >Ksp[Cu(OH)2]
A.A B.B C.C D.D
难度: 中等查看答案及解析