-
元素铈(Ce)是一种重要的稀土元素。
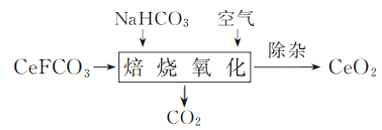
(1) 工业上用氟碳铈矿(主要成分为CeFCO3)制备CeO2。焙烧过程中发生的主要反应的化学方程式为________。
(2) 已知CeCl3·7H2O在空气中易被氧化成四价铈,反应如下:
① CeCl3·7H2O(s)=CeCl3(s)+7H2O(g);ΔH1=a kJ·mol-1
② 4CeCl3(s)+O2(g)+14H2O(g)=4Ce(OH)4(s)+12HCl(g);ΔH2=b kJ·mol-1
③ Ce(OH)4(s)=CeO2(s)+2H2O(g);ΔH3=c kJ·mol-1
则4CeCl3·7H2O(s)+O2(g)=4CeO2(s)+12HCl(g)+22H2O(g);ΔH=________。
(3) CeO2是汽车尾气净化催化剂中最重要的助剂,工作原理如图1所示。写出过程1发生反应的化学方程式:________________________________。
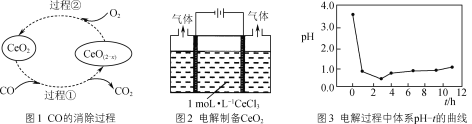
(4) 已知Ce(OH)4极易分解,用如图2所示装置电解CeCl3溶液在阴极区制得CeO2。电解过程中反应体系的pH随时间t的变化曲线如图3所示。
①电解进行1h内溶液的pH迅速下降,可能原因是________。
②请解释生成CeO2的原理:________。
(5) 常温下,当溶液中某离子浓度≤1.0×10-5时,可认为该离子沉淀完全。用Na2C2O4溶液对电解后的废液处理得到Ce2(C2O4)3固体,则应保持溶液中c(C2O42-)约为________。(已知25 ℃时,Ksp[Ce2(C2O4)3]=1.0×10-25)
-
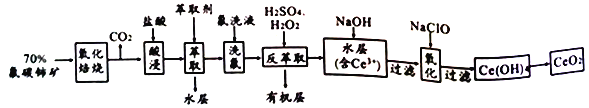
氟碳铈矿的主要化学成分为CeFCO3,它是提取铈族稀土元素的重要矿物原料,二氧化铈(CeO2) 是一种重要的稀土氧化物。以氟碳铈矿为原料制备CeO2的一种工艺流程如下:
已知:①Ce 4+既能与F 结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+ 能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1) “氧化焙烧”的目的是______________。
(2)“酸浸”中会产生大量黄绿色气体、请写出CeO2与盐酸反应的离子方程式___________________;为避免产生上述污染,请提出一种解决方案________________________。
(3)“萃取”时存在反应:Ce4++n(HA)2 Ce+(H2a-4A2a)+4H+。实验室中萃取时用到的主要玻璃仪器为______________;若缺少 “洗氟”,则所得产品的质量将_________(填“偏大”、“偏小”或 “不变”)。
Ce+(H2a-4A2a)+4H+。实验室中萃取时用到的主要玻璃仪器为______________;若缺少 “洗氟”,则所得产品的质量将_________(填“偏大”、“偏小”或 “不变”)。
(4) “反萃取”中,加稀硫酸和H2O2的作用__________________(用离子方程式表示)。
(5)取上述流程中得到的CeO2产品0.500g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不参加反应)消25.00mL标准溶液,该产品中CeO2的质量分数为________。
-
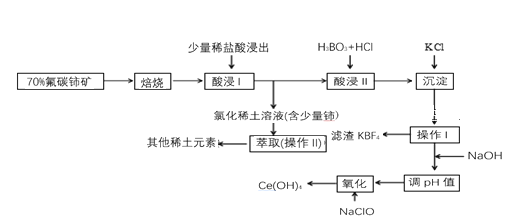
稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
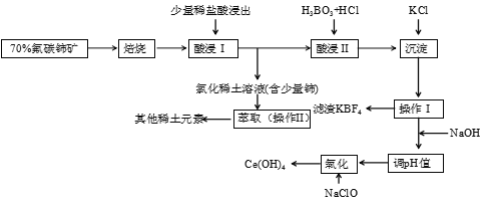
已知:i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:
9CeO2 + 3CeF4 + 45HCl + 3H3BO3 = Ce(BF4)3↓+ 11CeCl3 + 6Cl2↑+ 27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是______________________________________。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2 CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:___________________________________________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:___________________________________________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是_________________________________________________________
(3)向Ce(BF4)3中加入KCl溶液的目的是_____________________________________。
(4)操作I的名称为__________,在实验室中进行操作II时所需要的硅酸盐仪器有______。
(5)“操作I”后,向溶液中加入NaOH 溶液来调节溶液的pH, 以获得Ce(OH) 3沉淀,常温下加入NaOH 调节溶液的pH 应大 于 _______ 即可认为Ce3 +已完全沉淀。
(已知:Ksp[Ce(OH)3]=1.0×10-20 )
(6)取上述流程中得到的Ce(OH)4产品5.000 g,加酸溶解后,向其中加入含0.03300 molFeSO4的FeSO4溶液使Ce4 +全部被还原成Ce3 +,再用0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为________(已知氧化性:Ce4+>KMnO4; Ce(OH)4的相对分子质量为208)。
-
稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
已知:i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是_______。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2 CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是________。
(3)向Ce(BF4)3中加入KCl溶液的目的是______。
(4)操作I的名称为_______,在实验室中进行操作II时所需要的硅酸盐仪器有_______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的pH应大于________即可认为Ce3+已完全沉淀。(已知:Ksp[Ce(OH)3]=1.0×10-20)
(6)取上述流程中得到的Ce(OH)4产品5.000g,加酸溶解后,向其中加入含0.03300mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则该产品中Ce(OH)4的质量分数为______(已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208,保留3位有效数字)。
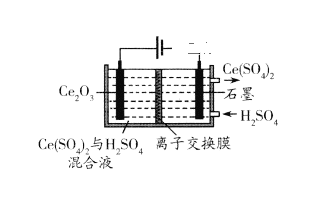
(7)在酸性条件下电解Ce2O3制备Ce(SO4)2(如下图),阳极电极反应式_______。
-
CeO2是一种重要的稀土氧化物,可利用氟碳铈矿(主要成分为CeFCO3)来制备。其工艺流程如下:
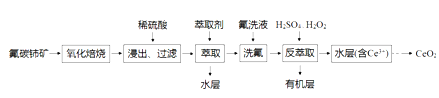
已知:I.Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+(0<x<4).
II.在硫酸体系中,Ce4+能被萃取剂萃取二Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是_________________。
(2)CeO2不溶于水和碱,微溶于酸,但“浸出”时却能溶解完全,原因是溶液中的_______(填原子符号,下同)、__________、_____________促进了CeO2的溶解。
(3)“反萃取”时发生反应的离子方程式为____________________。
(4)若缺少“洗氟”这一环节,则所得产品的质量将___________(填“偏大”“偏小”或“不变”)。
-
二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:
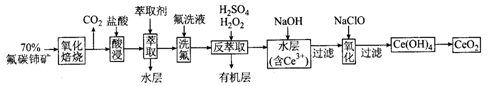
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:____________;为避免产生上述污染,请提出一种解决方案:_____________。
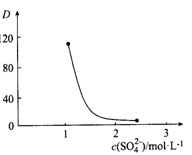
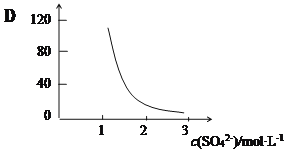
(3)“萃取”时存在反应:Ce4+ +n(HA)2 Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____________;下图中D时分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比( )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________。
(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作_________(填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________。
(5)“氧化”步骤的化学方程式为_____________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_________。
-
二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备 CeO2的一种工艺流程如下:
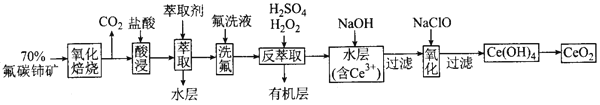
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是__________________。
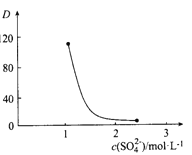
(2)“萃取”时存在反应:Ce4+ +n(HA)2 Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为__________________;下图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为__________________;下图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比( )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________________ 。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:__________________ 。
(3) “反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作__________________ (填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为__________________。
(4)“氧化”步骤的化学方程式为 ___________________ 。
(5)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为__________________。
-
二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
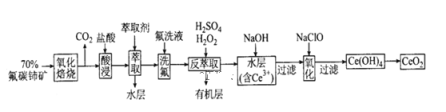
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
回答:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_________。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:___________;为避免产生上述污染,请提出一种解决方案:_______________________________。
(3)“萃取”时存在反应:Ce4++n(HA)2 Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____;下图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=c[Ce•(H2n-4A2n)]/c(CeSO42+))。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:___________。
Ce·(H2n-4A2n)+4H+。实验室中萃取时用到的主要玻璃仪器名称为____;下图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=c[Ce•(H2n-4A2n)]/c(CeSO42+))。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:___________。

(4)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作__________ (填“催化剂”“氧化剂”或“还原剂”),每有1molH2O2参加反应,转移电子的物质的量为_________。
(5)“氧化”步骤的化学方程式为:_____________________________。
(6)取上述流程中得到的CeO2产品0.4500 g,加硫酸溶解后,用0.1000mol/LFeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗25.00 mL标准溶液。该产品中CeO2的质量分数为_____。
-
二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
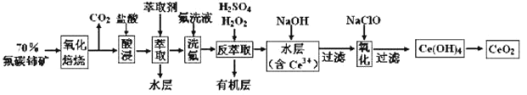
已知:
①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是___。
(2)“萃取”时存在反应:Ce4++n(HA)2⇌Ce•H2n-4A2n+4H+。实验室中萃取时用到的主要玻璃仪器名称为___;如图中D是分配比,表示Ce4+分别在有机层中与水层中存在形式的物质的量浓度之比 。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:___。
。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:___。
(3)“反萃取”中,在稀硫酸和H2O2的作用下Ce4+转化为Ce3+,H2O2在该反应中的作用是___(填“催化剂”“氧化剂”或“还原剂”)。
(4)“氧化”步骤的化学方程式为___。
(5)取上述流程中得到的CeO2产品0.43g,加硫酸溶解后,用0.1mol•L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗20.00mL标准溶液。该产品中CeO2的质量分数为___。
-
稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位,但近年来对其进行了掠夺性开采。二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如图:
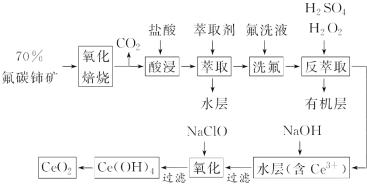
已知:①Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是__。
(2)“酸浸”中会产生大量黄绿色气体,写出CeO2与盐酸反应的离子方程式:__。为避免产生上述污染,请提出一种解决方案:__。
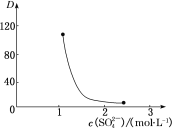
(3)“萃取”时存在反应:Ce4++n(HA)2 Ce·(H2n-4A2n)+4H+。如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=
Ce·(H2n-4A2n)+4H+。如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D= )。保持其他条件不变,D随起始料液中c(SO42-)变化的原因:__(用平衡移动原理解释)。
)。保持其他条件不变,D随起始料液中c(SO42-)变化的原因:__(用平衡移动原理解释)。
(4)若缺少“洗氟”,则所得产品的质量将__(填“偏大”“偏小”或“不变”)。
(5)“反萃取”中,H2O2作__(填“催化剂”“氧化剂”或“还原剂”)。
(6)“氧化”步骤的化学方程式为__。
(7)取上述流程中得到的CeO2产品0.4000g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其他杂质均不反应),消耗20.00mL标准溶液。该产品中CeO2的质量分数为__。滴定过程中可能造成实验结果偏低的是__(填字母)。
A.使用久置的FeSO4标准溶液
B.滴定终点时仰视读数
C.锥形瓶中溶液变色后立刻停止滴定,进行读数
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
















