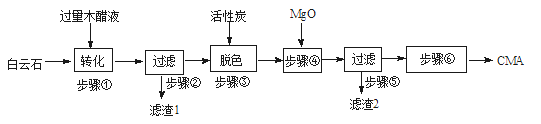
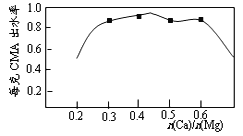
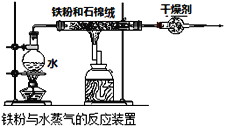
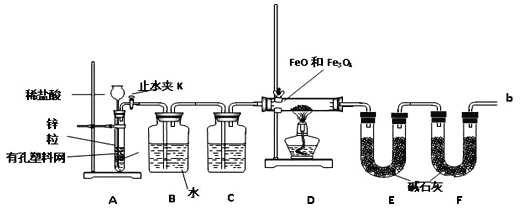
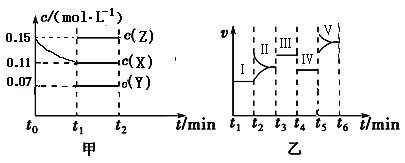
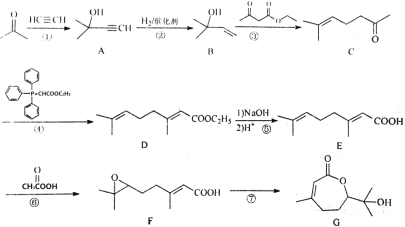
-
分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)( )
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关,下列有关说法与氧化还原反应无关的是( )
A.KNO3、KClO3与单质S、C2H5OH不能混搭存放在同一库房间
B.缺铁性补血服用补铁剂时,需与维C同时服用
C.铜制品、铁制品在潮湿的空气中生锈
D.用乙醚从黄花蒿中提取青蒿素
难度: 中等查看答案及解析
-
下列有机物相应说法正确的是( )
A.乙烷中混有乙烯,提纯方法:催化剂条件下与氢气混合反应
B.乙酸乙酯中混有乙酸,提纯方法:用过量饱和碳酸钠溶液洗涤后分液
C.乙醇中混有乙酸,验证乙酸存在的方法:加金属钠,看是否有气泡
D.蔗糖水解产物的验证:在冷却后的水解液中直接加入银氨溶液,水浴加热,看是否有银镜产生
难度: 中等查看答案及解析
-
下列判断合理的是
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③Na2O2、Fe2O3、A12O3属于碱性氧化物
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥CO2、SO2、NO2都能和碱溶液发生反应,因此它们都属于酸性氧化物.
A.只有①②④⑤ B.只有①②⑤ C.只有②⑤ D.只有②④⑥
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.用铜电极电解硝酸银溶液:4Ag+ + 2H2O
4Ag + O2↑ + 4H+
B.FeS中加入足量稀硝酸:FeS + 2 H+ = Fe2+ + H2↑
C.石灰石溶于醋酸溶液中:CaCO3 + 2H+ = Ca2+ + H2O + CO2 ↑
D.澄清石灰水中通入过量的CO2:CO2 + OH- = HCO3-
难度: 中等查看答案及解析
-
下列有关实验操作、现象、解释和结论都正确的是( )
选项
操作
现象
解释、结论
A
用玻璃棒蘸取浓氨水点到干燥红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
B
向饱和Na2CO3溶液中通入足量CO2
溶液变浑浊
析出了Na2CO3晶体
C
向蔗糖中加入浓硫酸并搅拌
蔗糖变黑,体积膨胀
反应中浓硫酸只体现脱水性
D
过量的Fe粉与氯气充分反应后,向反应后的混合物中加水,取上层清液滴入KSCN溶液
溶液不变红色
氯气将Fe氧化为Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的pH与氢氧化钠溶液体积V的关系如图所示。下列说法不正确的是( )
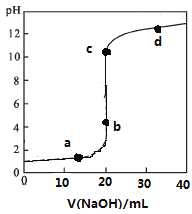
A.可选酚酞或甲基橙作指示剂
B.滴定前HR溶液中存在大量HR分子
C.V=20mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2
D.c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+)
难度: 中等查看答案及解析