-
(15分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;元素B的氢化物能用于刻蚀玻璃; C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是___________,A、B、C、D的第一电离能由小到大的顺序为__________。
(2)化合物CA的熔点远高于C的氯化物的熔点,理由是______________;
(3)A的最高价含氧酸根离子中,其中心原子采取_____杂化,D的低价氧化物分子的空间构型是_______。
(4)B2与NaOH溶液反应的产物之一是OB2,该反应的离子方程式为__________。
-
【化学—选修3:物质结构】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子; B元素是地壳中含量最多的金属元素;C原子核外的M层中有两对成对电子;D是使用最广泛的合金的主要成分。E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E+离子的最外层电子排布式_____________ ,A、B、C的第一电离能最小的是____________ 。
(2)A的最高价含氧酸分子中心原子是____________________杂化。
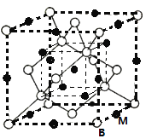
(3)A、B形成某种化合物的晶胞结构如下图一所示(“O”表示B原子),则其化学式为________ ,一个A原子周围距离最近且等距的A原子有_____________个。B原子的堆积方式与下图中的_______相同。(填“图二”或“图三”)

(4)1183 K 以下D 晶体的晶胞为钾型,而1183 K 以上则转变为铜型,在两种晶胞中最邻近的D 原子间距离相同,则两种晶体中原子的空间利用率之比为____(可用根号表示)。
(5)开发新型储氢材料是氢能利用的重要研究方向。分子X 可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X 一定不是______(填标号)。
A. H2O B. CH4 C. HF D. CO(NH2)2
-
(15分)已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为 。
(2)B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是 .
(4)E的最高价氧化物分子的空间构型是 。其中心原子的杂化方式为 。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为 。
(6)A、F形成某种化合物的晶胞结构如图所示, 则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
-
(15分)
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为________。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点________(填高或低),理由是________。
(3)E的最高价氧化物分子的空间构型是________。
(4)F的核外电子排布式是________,F的高价离子与A的简单氢化物形成的配离子的化学式为________.
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为________;(黑色球表示F原子)

(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为________。
-
(15分)
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为________。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点________(填高或低),理由是________。
(3)E的最高价氧化物分子的空间构型是________。
(4)F的核外电子排布式是________,F的高价离子与A的简单氢化物形成的配离子的化学式为________.
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为________;(黑色球表示F原子)
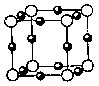
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为________。
-
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体 ,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为 。
(2)B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是 .
(4)E的最高价氧化物分子的空间构型是 。其中心原子的杂化方式为 。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为 。
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 ;(黑色球 表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
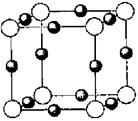
-
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为________。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点________(填高或低),理由是。
(3)E的最高价氧化物分子的空间构型是。
(4)F的核外电子排布式是,F的高价离子与A的简单氢化物形成的配离子的化学式为________。
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为________;(黑色球表示F原子)
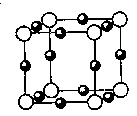
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型。
-
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属于周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点 (填“高”或“低”),理由是 。
(3)E的最高价氧化物分子的空间构型是 。
(4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 。
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 。(黑色球表示F原子)

(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料。其晶体中所含的化学键类型为 。
-
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为 。
(2)B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是 .
(4)E的最高价氧化物分子的空间构型是 。其中心原子的杂化方式为 。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为 。
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
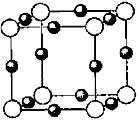
-
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为________。
(2)B、C、D的第一电离能由小到大的顺序为________。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是.
(4)E的最高价氧化物分子的空间构型是________。其中心原子的杂化方式为________。
(5)F的高价离子与A的简单氢化物形成的配离子,配位数为________。
(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为________;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为________ g/cm3。
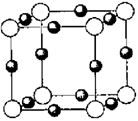

 则其化学式为
则其化学式为



