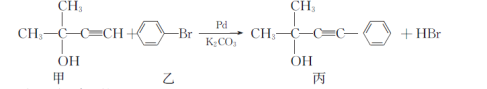
-
在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是
A. 1.12L H2 B. 1.12L O2 C. 2.24L H2 D. 2.24L O2
难度: 简单查看答案及解析
-
下列各组表达式意义相同的是
A.
B. HCOOCH3和HOOCCH3
C.
D. -NO2和NO2
难度: 简单查看答案及解析
-
下列说法正确的是
A.草木灰和铵态氮肥混合使用提高肥效
B.加热蒸干AlCl3溶液后,灼烧得到Al(OH)3固体
C.小苏打在水中的电离方程式:NaHCO3=Na++HCO3-
D.除去MgCl2溶液中的Fe3+,可在其中加入NaOH溶液
难度: 简单查看答案及解析
-
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键
H—H
Cl—Cl
Cl—H
键能/(kJ·mol-1)
436
243
431
请计算H2(g)+Cl2(g)===2HCl(g)的反应热( )
A.+862 kJ·mol-1 B.+679 kJ·mol-1 C.-183 kJ·mol-1 D.+183 kJ·mol-1
难度: 中等查看答案及解析
-
下列说法中正确的是
A.已知t1℃时,反应C+CO2
2CO △H>0的速率为υ,若升高温度,逆反应速率减小
B.恒压容器中发生反应N2+O2
2NO,若在容器中充入He,正逆反应速率均不变
C.当一定量的锌粉和过量的6mol⋅L−1盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向反应器中加入少量的CuSO4溶液
D.待反应PCl5(g)
PCl3(g)+Cl2(g) 达到平衡后,保持温度和体积不变,再充PCl5(g)达到新的平衡,新平衡和原平衡相比PCl5(g)的转化率减少
难度: 中等查看答案及解析
-
关于工业合成氨反应:N2+3H2
2NH3,下列说法错误的是
A. 增大N2浓度可以使H2转化率达到100℅
B. 降低体系温度有利于平衡朝正反应方向移动
C. 使用合适的催化剂可以缩短到达平衡的时间
D. 升高温度能加快反应速率
难度: 简单查看答案及解析
-
下列描述中,不符合生产实际的是
A.电解法精炼粗铜,用纯铜作阴极
B.在镀件上电镀锌,用锌作阳极
C.用如图装置为铅蓄电池充电
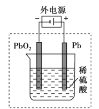
D.为了保护海轮的船壳,常在船壳上镶入锌块
难度: 简单查看答案及解析
-
惰性电极电解饱和食盐水,当溶液中有1mol NaOH生成时,则下列说法不正确的是
A.阴极析出氢气
B.标准状况下,阴极产生的气体为11.2L
C.阳极的电极反应式:2H2O + 2e-= 2OH-+ H2↑
D.电路中有1mol电子通过
难度: 简单查看答案及解析
-
在一定条件下,测得2CO2
2CO+O2(反应从CO2开始)平衡体系的平均相对分子质量为M,在此条件下,CO2的分解率为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
一种应用广泛的锂电池结构如图所示,LiPF6是电解质,SO(CH3)2作溶剂,反应原理是
。下列说法不正确的是
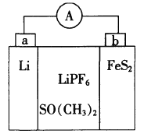
A.Li作负极
B.a极的电势比b极的电势高
C.b极的电极反应式是
D.电子是由a极沿导线移动到b极
难度: 中等查看答案及解析
-
关于下列装置说法正确的是( )
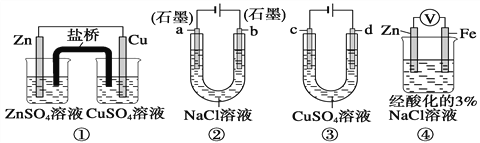
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 装置②工作一段时间后,a极附近溶液的pH增大
C. 用装置③精炼铜时,溶液中Cu2+的浓度一定始终不变
D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.已知 P(s,白磷) =P(s,红磷) ΔH<0,则白磷比红磷稳定
B.已知 2H2(g)+O2(g)=2H2O(g) ΔH="-483.6" kJ·mol-1,则氢气的燃烧热为 241.8 kJ·mol-1
C.已知 2C(s)+2O2(g)=2CO2(g) ΔH=a 2C(s)+O2(g)="2CO(g)" ΔH=b,则 a>b
D.已知 NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) ΔH="-57.3" kJ·mol-1,则含 40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ 的热量
难度: 中等查看答案及解析
-
25℃时,把0.2mol/L的醋酸加水稀释,那么图中的纵坐标y表示的是( )
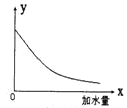
A.溶液中OH-的物质的量浓度 B.溶液的导电能力
C.溶液中的
D.醋酸的电离程度
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论不正确的是
选项
实验操作和现象
结论
A
向2mL浓度均为1.0mol⋅ L−1的NaCl、NaI混合溶液中滴加2~3滴0.0l mol⋅ L−1 AgNO3溶液,振荡,有黄色沉淀产生。
Ksp(AgCl)>Ksp(AgI)
B
向某溶液中加入Ba(NO3)2溶液有白色沉淀产生,再加入足量稀盐酸,白色沉淀不消失。
原溶液中有SO42−
C
向两支分别盛有0.1 mol⋅ L−1醋酸和硼酸溶液的试管中滴加等浓度的Na2CO3溶液,可观察到前者有气泡产生,后者无气泡产生。
电离常数:Ka(CH3COOH)> Ka1(H2CO3)> Ka(H3BO3)
D
在两支试管中各加入4mL0.01 mol⋅ L−1KMnO4酸性溶液和2 mL 0.1 mol⋅ L−1H2C2O4溶液,再向其中一支试管中快速加入少量MnSO4固体,加有MnSO4的试管中溶液褪色较快。
Mn2+对该反应有催化作用
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列指定溶液中一定能大量共存的离子组是
A.中性溶液中:K+、Al3+、Cl−、SO42−
B.含有大量AlO2−的溶液中:Na+、K+、HCO3−、NO3−
C.pH=1的溶液中:NH4+、Na+、Fe3+、SO42−
D.Na2S溶液中:SO42−、K+、Cu2+、Cl−
难度: 中等查看答案及解析
-
苯乙烯 (
)是合成泡沫塑料的主要原料。下列关于苯乙烯说法正确的是
A.苯和苯乙烯均可用于萃取水中的碘
B.苯乙烯不可能存在只含碳碳单键的同分异构体
C.苯乙烯在一定条件下加成可以得到
D.苯乙烯分子核磁共振氢谱共有4组峰
难度: 中等查看答案及解析
-
乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O
CH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是
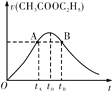
A.图中A、B两点表示的c(CH3COOC2H5)相等
B.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
C.图中t0时说明反应达到平衡状态
D.图中tB时CH3COOC2H5的转化率等于tA时的转化率
难度: 中等查看答案及解析
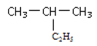 的系统命名为________________。
的系统命名为________________。