-
下列有关焓变与反应热的说法,正确的是
A.反应热和焓变的单位都是kJ
B.如果反应是在恒温恒压条件下进行的,此时的反应热与焓变相等
C.如果反应是在恒温恒容条件下进行的,此时的反应热与焓变相等
D.任何化学反应的反应热均可通过实验直接测定
难度: 简单查看答案及解析
-
判断下列关于焓变的说法正确的是( )
A.相同条件下反应2SO2(g)+O2(g)
2SO3(g)与4SO2(g)+2O2(g)
4SO3(g)的△H相等
B.甲烷的标准燃烧热为-890.3kJ/mol,则甲烷燃烧的热化学方程式可以表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
C.在一定温度和压强下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,则其热化学方程式为N2(g)+3H2(g)
2NH3(g) △H=-38.6kJ·mol-1
D.一定条件2SO2(g)+O2(g)
2SO3(g) △H1,2SO2(g)+O2(g)
2SO3(l) △H2,则△H1>△H2
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是( )
A.2SO2+O2=2SO3;△H=-196.6kJ·mol-1
B.C(s)+O2(g)=CO2(g);△H=393.5kJ·mol-1
C.H+(aq)+OH-(aq)=H2O(l);△H=57.3kJ·mol-1
D.
H2(g)+
Cl2(g)=HCl(g);△H=-92.5kJ·mol-1
难度: 中等查看答案及解析
-
已知燃烧7.8g乙炔气体生成CO2气体和液态水,放出390kJ的热量,则下列有关乙炔气体燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H═-390kJ·mol-1
B.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g) △H═-2600kJ·mol-1
C.C2H2(g)+2.5O2(g)═2CO2(g)+H2O(l) △H═-1300kJ·mol-1
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H═-1300kJ·mol-1
难度: 中等查看答案及解析
-
在一定条件下,氮气与氢气合成氨气的能量变化的曲线如图,下列叙述正确的是( )
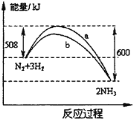
A.a历程使用了催化剂,b历程没有使用催化剂
B.使用催化剂可提高氮气的转化率
C.相同状况下,lmol氮气和3mol氢气总键能高于2mol氨气的总键能
D.该反应的热化学方程式为N2(g)+3H2(g)
2NH3(g) △H=-92kJ·mol-1
难度: 中等查看答案及解析
-
下列有关化学反应方向及其判据的说法中错误的是( )
A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]
B.已知某自发反应A(g)+B(g)=2C(g)△H>0,则△S<0
C.CaCO3(s)=CaO(s)+CO2(g)△H>0能否自发进行与温度有关
D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
难度: 中等查看答案及解析
-
下列化学反应能设计成原电池的是( )
A.CaCO3+2HCl═CaCl2+H2O+CO2↑ B.BaCl2+Na2SO4═2NaCl+BaSO4↓
C.2NaOH+CO2═Na2CO3+H2O D.Fe+CuCl2═FeCl2+Cu
难度: 简单查看答案及解析
-
下列关于新能源的说法正确的是( )
A.沼气与瓦斯都是新能源,但其主要成分不同
B.目前科学家在太阳能、氢能、风能、地热能等领域已取得了一定的进展
C.氢能的热值低于汽油
D.风能的来源与太阳能无关
难度: 简单查看答案及解析
-
关于原电池的说法正确的是( )
A.电流从原电池的负极流向正极
B.电子从发生还原反应的电极流出
C.原电池是将化学能转变为电能的一种装置
D.原电池的两个电极,一定是由活动性不同的两种金属组成
难度: 简单查看答案及解析
-
下列关于原电池的叙述中正确的是( )
A.在镁、铝、稀NaOH溶液组成的原电池中,镁是负极,铝是正极
B.在铁、铝、稀硫酸组成的原电池中,电子由铁片通过导线流向铝片
C.在锌、铜、稀硫酸组成的原电池中,当电池工作时,硫酸根离子向正极移动
D.在锌、铜、CuSO4溶液组成的原电池中,负极质量减轻,正极质量增加
难度: 中等查看答案及解析
-
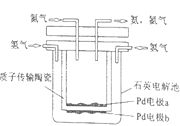
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。下列对该燃料电池的说法中,正确的是( )
A.在熔融的电解质中,O2-由负极移向正极
B.电池的总反应是:2C4H10+13O2=8CO2+10H2O
C.通入空气的一极是发生氧化反应,电极反应为O2+4e-=2O2-
D.通入丁烷的一极是正极,电极反应为C4H10+26e-+13O2-=4CO2+5H2O
难度: 中等查看答案及解析
-
全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
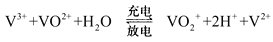 。下列说法正确的是
。下列说法正确的是A.放电时正极反应为:
B.充电时阴极反应为:
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区向阳极区迁移
难度: 中等查看答案及解析
-
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
难度: 中等查看答案及解析
-
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
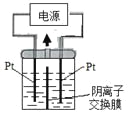
已知:3I2+6OH-=IO3-+5I-+3H2O
下列说法不正确的是
A.右侧发生的电极方程式:2H2O+2e-=H2↑+2OH-
B.电解结束时,右侧溶液中含有IO3-
C.电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
难度: 中等查看答案及解析
-
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
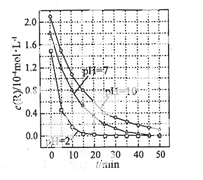
A.在0-50min之间, pH =2和 PH= 7时 R 的降解百分率相等
B.溶液酸性越强, R 的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在 20-25min之间, pH =10时 R 的平均降解速率为 0.04mol·L-1·min-1
难度: 中等查看答案及解析
-
下列反应中,熵显著增加的反应是( )
A.CO(g)+2H2(g)=CH3OH(g)
B.CaCO3+2HCl=CaCl2+H2O+CO2↑
C.C(s)+O2(g)=CO2(g)
D.2Hg(l)+O2(g)=2HgO(s)
难度: 简单查看答案及解析
-
已知反应①CO(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=c(CO2).c(Cu)/[c(CO).c(CuO)]
B.反应③的平衡常数K=K1/K2
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
难度: 中等查看答案及解析
-
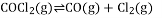
,当反应达到平衡时,下列措施:①升温,②恒容通入惰性气体,③增大CO的浓度,④扩大容积,⑤加催化剂,⑥恒压通入惰性气体,能提高
转化率的是( )
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
难度: 中等查看答案及解析
-
加入Al能产生H2的溶液中一定能大量共存的是
A.K+、Na+、Br-、SO42- B.Na+、Fe2+、NO3-、Cl-
C.Ca2+、Cl-、HCO3-、K+ D.NH4+、K+、OH-、SO42-
难度: 中等查看答案及解析
-
将充满NO2和O2混合气体的10mL试管倒置在水槽中,充分反应后试管内剩余5mL无色气体,则原混合气体中NO2和O2的体积比为( )
A.1:2 B.1:3 C.2:3 D.3:2
难度: 中等查看答案及解析
-
25℃时,由水电离出来的c(H+)=1×10-12,则关于溶液的pH的说法正确的是( )
A.可能2或12 B.一定是2 C.一定是12 D.一定是7
难度: 简单查看答案及解析
-
已知在25℃和35℃时,水的离子积分别为K(25℃)=1.0×10-14、K(35℃)=2.1×10-14,则下列叙述中正确的是( )
A.c(H+)随温度的升高而降低 B.35℃时纯水中c(H+)﹥c(OH-)
C.水的电离度:α(25℃)﹥α(35℃) D.纯水的pH可能小于7
难度: 简单查看答案及解析
-
下列关于中和滴定的说法中正确的是( )
A.中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2-3mL
B.滴定管、锥形瓶均先水洗后润洗
C.滴定时眼睛应注视锥形瓶内溶液的颜色变化而不应注视滴定管内液面变化
D.用标准盐酸滴定待测NaOH溶液,滴定前仰视,滴定后俯视,则结果偏大
难度: 简单查看答案及解析
-
下列有关水溶液中的离子问题的叙述中正确的是( )
A.pH=12的氨水和pH=2的盐酸等体积混合,c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=11的氨水溶液稀释后,恢复至原温度,pH和Kw均减小
C.向一定量的醋酸溶液中逐滴加入物质的量浓度相同的氢氧化钠溶液,直至氢氧化钠过量,在实验过程中水的电离程度的变化趋势是先小后大
D.溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3)
难度: 中等查看答案及解析
-
室温下,相同体积的pH=2的醋酸和盐酸溶液分别采取下列措施,有关叙述正确的是
A.加水稀释100倍后,两溶液的pH均为4
B.使温度都升高20℃后,两溶液的pH均不变
C.与足量的锌反应,盐酸的反应速率比醋酸大
D.加足量的锌充分反应后,醋酸产生的氢气比盐酸多
难度: 中等查看答案及解析