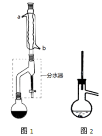-
巴黎气候大会揭开了发展低碳经济的宏伟序幕,下列有关说法正确的是
A.太阳能、地热能、核能、化石燃料等均属于“新能源”
B.减少含碳物质做燃料符合“低碳”理念
C.图中转化途径不能体现“节能减排”的思想
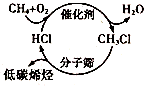
D.节约用电不能减少CO2的排放量
难度: 简单查看答案及解析
-
下列有关物质的叙述正确的是
A.沼气和天然气都是可再生能源
B.盐酸和醋酸既是化合物又是酸
C.冰和干冰既是纯净物又是化合物
D.豆浆、牛奶和油脂都属于胶体
难度: 简单查看答案及解析
-
下列叙述不正确的是
A.标准状况下,22.4LNO与11.2LO2混合,混合气体所含分子数为NA
B.1molAl3+含有的核外电子数为10NA
C.常温常压下,1mol氮气含有的原子总数为NA
D.1L1mol/LFeCl3溶液全部制成胶体,其中含胶粒的数目小于NA
难度: 中等查看答案及解析
-
下列实验操作或装置(略去部分夹持仪器)正确的是
A.配制溶液
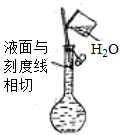
B.中和滴定
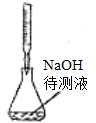
C.制备乙酸乙酯
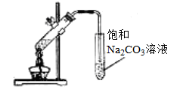
D.制备收集干燥的氨气
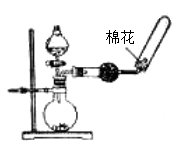
难度: 中等查看答案及解析
-
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是
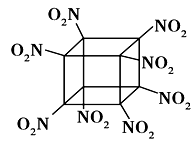
A.分子中不含有非极性键
B.1mol该分子中含8mol二氧化氮
C.该物质既有氧化性又有还原性
D.该物质爆炸产物是NO2、CO2、H2O
难度: 困难查看答案及解析
-
已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列叙述中正确的是
A.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小
B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色
C.将0.001mol/L的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
D.向AgCl的饱和溶液中加入NaCl晶体有AgCl析出,溶液中c(Ag+)仍与c(Cl-)相等
难度: 中等查看答案及解析
-
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实解释正确的是
现象
解释
A
KI淀粉溶液中通入Cl2,溶液变蓝
Cl2能与淀粉发生显色反应
B
浓HNO3在光照条件下变黄
浓HNO3不稳定,生成有色产物能溶于浓硝酸
C
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
说明该溶液中含有SO42-
D
向盐酸中加入浓硫酸时产生白雾
说明浓硫酸具有脱水性
难度: 中等查看答案及解析
-
某有机化合物的结构简式为:
;其中属于芳香醇的同分异构体共有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
难度: 困难查看答案及解析
-
已知分解1molH2O2放出热量98kJ。在含少量I-的溶液中,H2O2分解的机理为:①H2O2+I-→H2O+IO-(慢)②H2O2+IO-→H2O+O2+I-(快)下列有关该反应的说法正确的是
A.反应速率与I-浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98kJ/mol
D.v(H2O2)=v(H2O)=v(O2)
难度: 困难查看答案及解析
-
SO2既有氧化性又有还原性,通常以还原性为主,Fe3+和Cr2O72-具有氧化性。将SO2与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,前后依次发生两个氧化还原反应。据此下列有关说法正确的是
A.还原性:Cr3+>Fe2+>SO2
B.氧化性:Cr2O72->SO2>Fe3+
C.足量的SO2也不能使Fe2(SO4)3溶液完全褪去颜色
D.Fe2(SO4)3在前一个反应中做氧化剂,后一个反应中做还原剂
难度: 困难查看答案及解析
-
下列反应的离子方程式不正确的是
A.Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.FeCl3溶液中加入少量Na2S溶液:2Fe3++S2-=2Fe2++S↓
C.将适量CO2通入NaClO溶液中(已知次氯酸的K1为2.95×10-8,H2CO3的K2=5.6×10-11):2ClO-+CO2+H2O=CO32-+2HClO
D.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-=CO32-+CaCO3↓+2H2O
难度: 困难查看答案及解析
-
镍镉电池是一种十分常见的二次电池,它具有成本低、性能好的优点。该电池充、放电时的反应为:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2。下图用该电池电解AgNO3溶液,M、N是代表电池的两极,P、Q表示两惰性电极,Cd的相对原子质量为112,则下列有关说法不正确的是
A.N是镍镉电池的负极,其电极反应为Cd+2OH--2e-=Cd(OH)2
B.当N极有11.2gCd溶解时,P极放出气体2.24L
C.K闭合后的短时间内,N极区溶液的pH变小
D.Q是电解池的阴极,其电极反应为Ag++e-=Ag
难度: 困难查看答案及解析
-
下列溶液中粒子的物质的量浓度关系正确的是
A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:
c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B.20mL0.1mol/LCH3COONa溶液与10mL0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:
c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:
c(OH-)>c(H+)+c(CH3COOH)
难度: 困难查看答案及解析
-
一元弱酸HA(aq)中存在下列电离平衡:HA
H++A-,如图将1.0molHA分子加入1.0L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是
A.
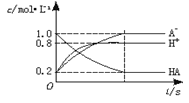 B.
B.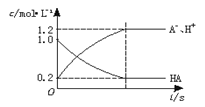
C.
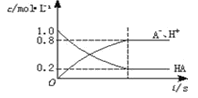 D.
D.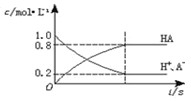
难度: 中等查看答案及解析
-
增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得,下列叙述正确的是

A.邻苯二甲酸酐属于酸性氧化物
B.环己醇分子中所有的原子可能共平面
C.DCHP能发生加成、取代、消去反应
D.1molDCHP最多可与含2molNaOH的烧碱溶液反应
难度: 中等查看答案及解析

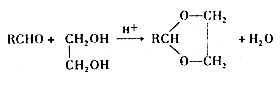
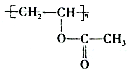 。
。