-
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
A. 配合物中中心原子的电荷数和配位数均为6
B. 该配合物可能是平面正方形结构
C. Cl-和NH3分子均为Pt4+配体
D. 配合物中Cl-与Pt4+配位,而NH3分子不配位
难度: 中等查看答案及解析
-
X与Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Y与Z两元素的核外电子层数相同,Z元素的第一电离能大于Y元素的第一电离能,则X、Y、Z的原子序数
A. X>Y>Z B. Y>X>Z
C. Z>X>Y D. Z>Y>X
难度: 简单查看答案及解析
-
下列性质体现了金属通性的是( )
A. 银不易生锈 B. 铁常温下不溶于浓硝酸
C. 钠与水剧烈反应放出氢气 D. 金属具有良好的延展性
难度: 简单查看答案及解析
-
当H原子和F原子沿z轴结合成HF分子时,F原子中和H原子对称性不一致的轨道是( )
A. 1s B. 2s C. 2px D. 2pz
难度: 简单查看答案及解析
-
已知某元素的+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中的位置正确的是( )
A. 第三周期ⅣA族,p区
B. 第四周期ⅡB族,s区
C. 第四周期Ⅷ族,d区
D. 第四周期ⅡA族,s区
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 含有非极性键的分子一定是非极性分子
B. 非极性分子中一定含有非极性键
C. 由极性键形成的双原子分子一定是极性分子
D. 两个原子之间共用两对电子,形成的化学键一定有极性
难度: 简单查看答案及解析
-
H2O分子中每个O原子结合2个H原子的根本原因是( )
A. 共价键的方向性 B. 共价键的饱和性
C. 共价键的键角 D. 共价键的键长
难度: 中等查看答案及解析
-
下列物质属于等电子体的一组是( )
A. CH4和NH3 B. B3H6N3和C6H6
C. F-和Mg D. H2O和CH4
难度: 中等查看答案及解析
-
能与氢氧化钠溶液反应且属化合物的原子晶体是( )
A. 铝 B. 金刚石 C. 硅 D. 二氧化硅
难度: 中等查看答案及解析
-
N—H键键能的含义是( )
A. 由N和H形成1 mol NH3所放出的能量
B. 把1 mol NH3中的共价键全部拆开所吸收的能量
C. 拆开约6.02×1023个N—H键所吸收的能量
D. 形成约1个N—H键所放出的能量
难度: 简单查看答案及解析
-
下列有关晶体和非晶体的说法中正确的是( )
A. 具有规则几何外形的固体均为晶体
B. 晶体具有自范性,非晶体没有自范性
C. 晶体研碎后即变为非晶体
D. 将玻璃加工成规则的固体即变成晶体
难度: 简单查看答案及解析
-
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含有6.02*1022个碳原子
C石墨烯是一种有机物
D.石墨烯中的碳原子间以共价键结合
难度: 中等查看答案及解析
-
根据π键的成键特征判断C=C的键能是C—C键能的( )
A. 2倍 B. 大于2倍 C. 小于2倍 D. 无法确定
难度: 中等查看答案及解析
-
关于晶体和非晶体的说法,正确的是( )
A. 晶体在三维空间里呈周期性有序排列,因此在各个不同的方向上具有相同的物理性质
B. 晶体在熔化过程中需要不断的吸热,温度不断地升高
C. 普通玻璃在各个不同的方向上力学、热学、电学、光学性质相同
D. 晶体和非晶体之间不可以相互转化
难度: 中等查看答案及解析
-
下列说法中正确的是
A. s区都是金属元素 B. s区都是主族元素
C. 稀有气体在ds区 D. 所有非金属元素都在p区
难度: 中等查看答案及解析
-
对配合物[Cu(NH3)4]SO4的叙述,错误的是( )
A. Cu2+和NH3之间以配位键结合
B. [Cu(NH3)4]2+和SO42-之间以离子键结合
C. Cu2+和NH3之间以离子键结合
D. [Cu(NH3)4]SO4在水中全部电离成[Cu(NH3)4]2+和SO42-
难度: 简单查看答案及解析
-
下列各元素最易形成离子化合物的是( )
①第三周期第一电离能最小的元素 ②价电子构型为2s22p6的原子 ③2p能级为半满的元素 ④电负性最大的元素
A. ①② B. ③④ C. ②③ D. ①④
难度: 简单查看答案及解析
-
下列物质中含离子键的是( )
A. Cl2 B. CO2 C. NaCl D. CH4
难度: 简单查看答案及解析
-
具有下列特征的元素,一定是非金属元素的是( )
A. 对应氢氧化物是两性氢氧化物 B. 具有负化合价
C. 最高价氧化物对应的水化物是酸 D. 具有可变化合价
难度: 简单查看答案及解析
-
根据下列五种元素的电离能数据(单位:kJ·mol-1),判断下列说法不正确的是( )
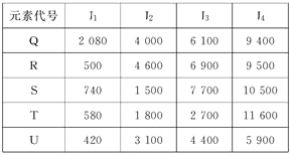
A. 元素的电负性最大的可能是Q元素
B. R和S均可能与U在同一主族
C. U元素可能在周期表的s区
D. 原子的价电子排布为ns2np1的可能是T元素
难度: 简单查看答案及解析
-
关于金属晶体的六方最密堆积的结构形式的叙述正确的是( )
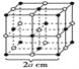
A. 晶胞是六棱柱 B. 晶胞是六面体
C. 每个晶胞中含4个原子 D. 每个晶胞中含17个原子
难度: 简单查看答案及解析
-
镁铝合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等,下列与这些用途无关的性质是( )
A. 不易生锈 B. 导电性好
C. 密度小 D. 强度高
难度: 简单查看答案及解析
-
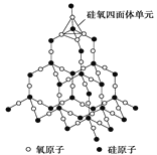
二氧化硅晶体是空间立体网状结构,如图所示:
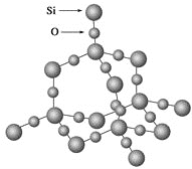
关于二氧化硅晶体的下列说法中,正确的是( )
A. 1 mol SiO2晶体中Si—O键为2 mol
B. 二氧化硅晶体的分子式是SiO2
C. 晶体中Si、O原子最外电子层都满足8电子结构
D. 晶体中最小环上的原子数为8
难度: 简单查看答案及解析
-
表中原子化热、晶格能、键能的单位都是kJ•mol﹣1
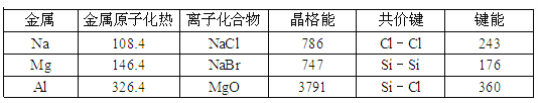
则下列说法正确的是
A. Na(s)与Cl2(g)反应生成1mol NaCl(s)放出的热量为556.1kJ
B. Si(s)+2Cl2(g)═SiCl4(g)△H=﹣602kJ•mol﹣1
C. 从表中可以看出,氯化钠的熔点比晶体硅高
D. 从表中数据可以看出,微粒半径越大金属键、离子键越弱,而共价键却越强
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
难度: 中等查看答案及解析
-
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的( )
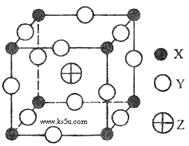
A. ZXY3 B. ZX2Y6 C. ZX4Y8 D. ZX8Y12
难度: 中等查看答案及解析
-
高温下,超氧化钾晶体呈立方体结构.晶体中氧的化合价部分为0价,部分为﹣2价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元).则下列说法正确的是( )
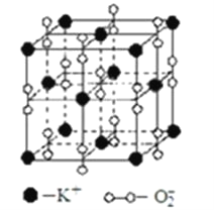
A. 超氧化钾的化学式为KO2,每晶胞含有14个K+和13个O2﹣
B. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中,0价氧原子与﹣2价氧原子的数目比为3:1
难度: 中等查看答案及解析
-
高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )
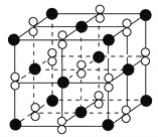
A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
难度: 困难查看答案及解析
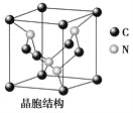
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;