-
化学无处不在,下列与化学知识有关的说法正确的是
A.利用蓝绿藻等低等植物和微生物在阳光作用下使水分解产生氢气并放出热量
B.处理锅炉水垢中的
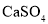 ,可先用饱和
,可先用饱和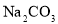 溶液浸泡,后加盐酸除去
溶液浸泡,后加盐酸除去C.军舰船底镶嵌锌块作正极,以防船体被腐蚀
D.草木灰与铵态氮肥不能混合施用,否则会造成草木灰肥效的损失
难度: 简单查看答案及解析
-
由合成气制备二甲醚,涉及如下反应:
(i)
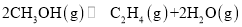
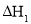
(ii)
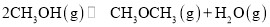
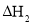
反应能量变化如图所示。下列说法正确的是
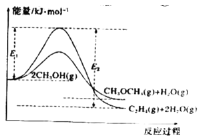
A.
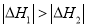
B.反应(ⅱ)为吸热反应
C.
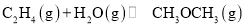
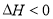
D.若在容器中加入催化剂,则
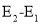 将变小
将变小难度: 中等查看答案及解析
-
已知:

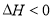 。现将一定量
。现将一定量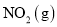 和
和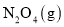 的混合气体通入体积为
的混合气体通入体积为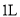 的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法错误的是[v(正)、
的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法错误的是[v(正)、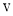 (逆)均用
(逆)均用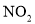 表示]
表示]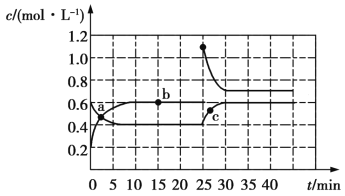
A.a点时:v(正)>v(逆) B.b点时体系颜色不再变化
C.b点的v(正)小于c点的v(逆) D.混合气体的密度:b点<c点
难度: 困难查看答案及解析
-
将汽车尾气中的CO、NO转化为无害气体的反应为:2NO(g)+2CO(g)
 N2(g)+2CO2(g)。某化学兴趣小组为探究影响该反应的外界条件,在容积均为2 L的甲、乙、丙三个恒温容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间
N2(g)+2CO2(g)。某化学兴趣小组为探究影响该反应的外界条件,在容积均为2 L的甲、乙、丙三个恒温容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间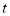 的变化情况如下表所示。根据表中数据,下列说法正确的是( )
的变化情况如下表所示。根据表中数据,下列说法正确的是( )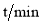
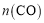
0
40
80
120
160
甲(温度为300℃)
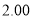
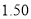
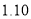
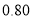
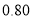
乙(温度为
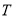 ℃)
℃)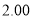
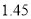
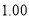
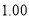
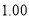
丙(温度为300℃)
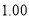
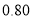
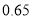
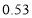
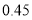
A.乙容器中的反应温度T<300℃
B.甲容器中,0~40 min内平均反应速率v(NO)=0.0125 mol/(L·min)
C.提高尾气净化效率的最佳途径是使用高效催化剂
D.升高温度既能增大反应速率又能提高CO与NO的转化率
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、
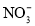 、
、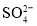 、Na+
、Na+B.由水电离出的c(H+)=1×10-14 mol/L的溶液中:Ca2+、Cl-、
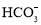 、K+
、K+C.
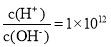 的溶液中:
的溶液中: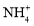 、
、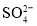 、
、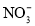 、Mg2+
、Mg2+D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、
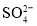 、SCN-
、SCN-难度: 中等查看答案及解析
-
工业上可通过甲醇羰基化法制取甲酸甲酯(HCOOCH3):CH3OH(g)+CO(g)
 HCOOCH3(g)。在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图所示,下列说法错误的是( )
HCOOCH3(g)。在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图所示,下列说法错误的是( )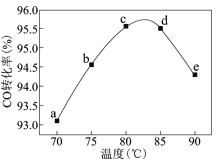
A.该反应的△H<0 B.增大压强甲醇转化率增大
C.平衡常数:
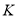 (75℃)>K(85℃) D.反应速率:v(c点)>v(e点)
(75℃)>K(85℃) D.反应速率:v(c点)>v(e点)难度: 中等查看答案及解析
-
下列说法错误的是
A.进行酸碱中和滴定实验时,眼睛须注视着锥形瓶内的颜色变化
B.除去
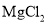 溶液中少量
溶液中少量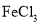 杂质,加入稍过量的
杂质,加入稍过量的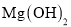 固体后过滤
固体后过滤C.配制
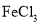 溶液时,将
溶液时,将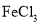 固体溶于稀硫酸中,然后稀释至所需浓度
固体溶于稀硫酸中,然后稀释至所需浓度D.将
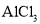 溶液和
溶液和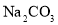 溶液分别加热蒸干、灼烧后,所得固体为
溶液分别加热蒸干、灼烧后,所得固体为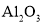 和
和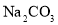
难度: 困难查看答案及解析
-
下列有关水处理的离子方程式书写错误的是
A.沉淀法:用
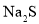 处理含
处理含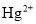 废水,
废水,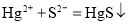
B.中和法:用生石灰
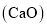 中和酸性废水,
中和酸性废水,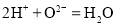
C.氧化法:用
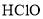 处理氨氮废水,2NH4++3HClO=N2↑+3H2O+5H++3Cl-
处理氨氮废水,2NH4++3HClO=N2↑+3H2O+5H++3Cl-D.混凝法:用明矾凝聚沉降细颗粒物,
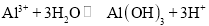
难度: 中等查看答案及解析
-
下列实验实验方案不能达到相应目的的是( )
A
B
C
D
目的
比较不同催化剂对化学反应速率的影响
进行粗铜的精炼
比较碳酸根与碳酸氢根水解程度
比较碳酸、醋酸和硼酸酸性强弱
实验方案
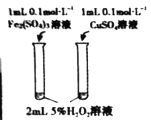
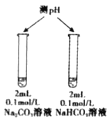
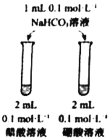
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列实验操作所对应的现象(或其他)、结论均正确的是
操作
现象(或其他)
结论
A
将铁片和铜片用导线连接后插入盛有浓硝酸的烧杯中组成原电池
铜片上有大量红棕色气体产生
铁比铜活泼
B
向含有酚酞的
 训加入少量
训加入少量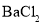 溶液
溶液颜色变浅
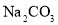 的电离平衡向右移动
的电离平衡向右移动C
用
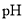 试纸测定
试纸测定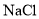 溶液和
溶液和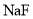 溶液的
溶液的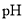
pH(NaCl)>pH(NaF)
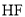 溶于水完全电离
溶于水完全电离D
向足量溶液中滴加2滴氯水,再分别滴加①淀粉溶液②溶液
①溶液变蓝
②无明显现象
还原性:I->Fe2+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
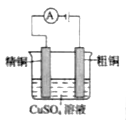
下列实验装置及其应用的描述均正确的是
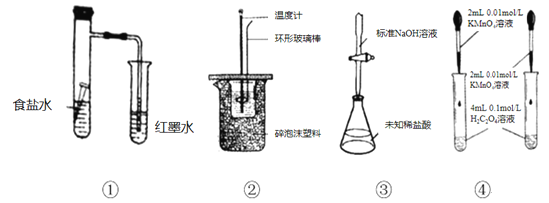
A.用①装置验证铁钉的析氢腐蚀
B.用②装置进行强酸强碱稀溶液的中和热测定
C.用③装置测定未知稀盐酸的物质的量浓度
D.用④装置探究反应物浓度对反应速率的影响
难度: 中等查看答案及解析
-
下列有关电化学原理与应用的叙述错误的是
Ⅰ
Ⅱ
Ⅲ
Ⅳ
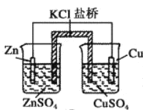
A.Ⅰ装置盐桥中的
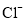 移向
移向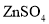 溶液
溶液B.Ⅱ中正极反应式为
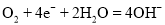
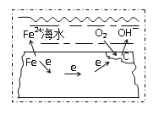
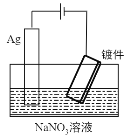
C.Ⅲ装置模拟工业上在镀件上镀银
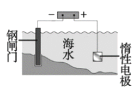
D.Ⅳ装置可以达到保护钢闸门的目的
难度: 中等查看答案及解析
-
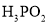 可通过“四室电渗析法”制备。制备的工作原理如图所示(阳膜只允许阳离子通过),下列叙述正确的是
可通过“四室电渗析法”制备。制备的工作原理如图所示(阳膜只允许阳离子通过),下列叙述正确的是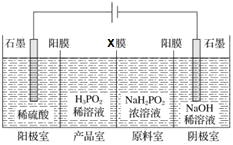
A.电解一段时间后,阳极室
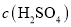 变小
变小B.电解一段时间后,阴极室
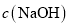 变小
变小C.
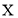 膜为阴膜(只允许阴离子通过)
膜为阴膜(只允许阴离子通过)D.阴、阳两极产生的气体的物质的量比为
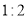
难度: 中等查看答案及解析
-
常温下,用
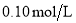 的
的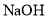 溶液滴定
溶液滴定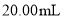
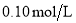 醋酸溶液的滴定曲线如图所示。下列说法正确的是
醋酸溶液的滴定曲线如图所示。下列说法正确的是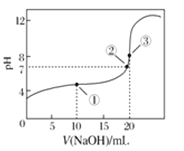
A.滴定过程中可能出现:
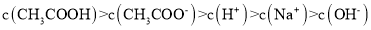
B.点①所示溶液中:
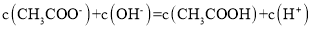
C.点②所示溶液中:
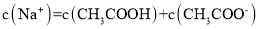
D.点③所示溶液中:
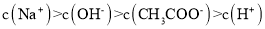
难度: 困难查看答案及解析
-
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结。他们归纳正确的是
A.常温下,
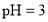 的醋酸溶液与
的醋酸溶液与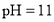 的
的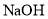 溶液等体积混合,则有
溶液等体积混合,则有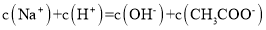
B.对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
C.有气体参加的反应,增大压强(压缩体积),活化分子百分数增大,平衡常数增大
D.常温下,醋酸电离平衡常数的
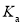 ,醋酸根水解平衡常数为
,醋酸根水解平衡常数为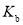 ,则有
,则有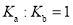
难度: 中等查看答案及解析
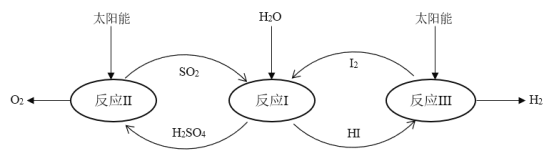
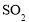 和
和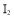 对总反应起到了催化剂的作用
对总反应起到了催化剂的作用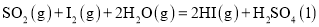
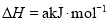
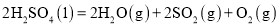
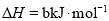
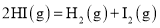
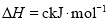
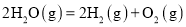
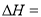 ______
______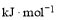 (用含
(用含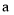 、
、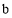 、
、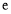 的代数式表示)。
的代数式表示)。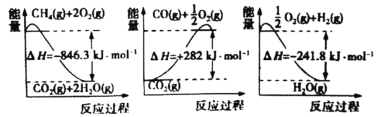
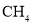 的燃烧热为
的燃烧热为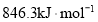 B.
B.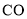 的燃烧热为
的燃烧热为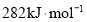
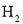 的燃烧热为
的燃烧热为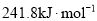 D.
D.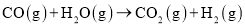 为放热反应
为放热反应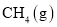 与
与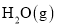 反应生成
反应生成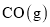 和
和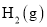 的热化学方程式为________________________。
的热化学方程式为________________________。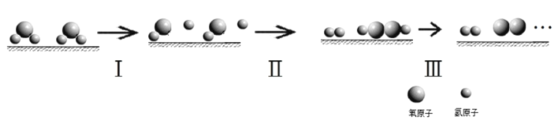
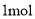 共价键释放(吸收)的能量]如下表所示。
共价键释放(吸收)的能量]如下表所示。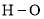
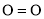
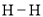
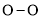
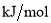
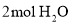 ,过程Ⅲ的
,过程Ⅲ的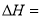 ______
______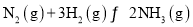
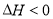 。
。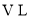 的密闭容器中发生上述反应,其平衡常数
的密闭容器中发生上述反应,其平衡常数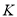 与温度
与温度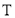 的关系如表:
的关系如表: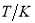
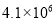
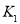
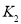
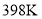 时,进行合成氨反应,下列能说明该反应已达到平衡状态的是______(填字母序号)。
时,进行合成氨反应,下列能说明该反应已达到平衡状态的是______(填字母序号)。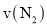 正
正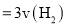 逆
逆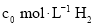 参加合成氨的反应,在
参加合成氨的反应,在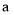 、
、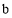 两种条件下分别达到平衡,测得
两种条件下分别达到平衡,测得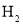 的浓度与反应时间的关系如图甲所示。请回答下列问题:
的浓度与反应时间的关系如图甲所示。请回答下列问题: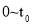 的平均反应速率
的平均反应速率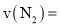 ______
______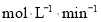 。
。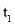 时刻将容器容积压缩至原来的
时刻将容器容积压缩至原来的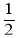 ,
,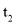 时刻重新建立平衡状态。则图甲中在
时刻重新建立平衡状态。则图甲中在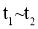 时刻
时刻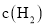 的变化曲线可能为______(填图甲中的字母序号)。
的变化曲线可能为______(填图甲中的字母序号)。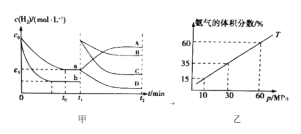
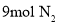 和
和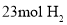 ,模拟合成氨的反应,图乙表示温度
,模拟合成氨的反应,图乙表示温度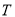 时平衡混合物中氨气的体积分数与总压强
时平衡混合物中氨气的体积分数与总压强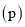 的关系图。若体系在
的关系图。若体系在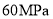 下达到平衡。
下达到平衡。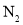 的平衡分压为______
的平衡分压为______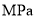 。(分压=总压×物质的量分数)
。(分压=总压×物质的量分数)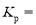 ______。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
______。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)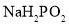 还原法”制备高纯度氢碘酸和亚磷酸钠
还原法”制备高纯度氢碘酸和亚磷酸钠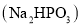 的工业流程如图。
的工业流程如图。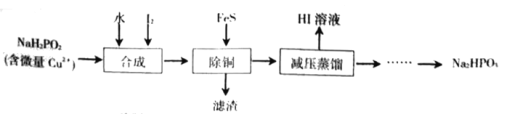
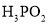 为一元弱酸
为一元弱酸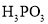 为二元酸,25℃时其电离常数:
为二元酸,25℃时其电离常数: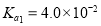 ,
,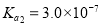
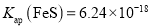 ,
,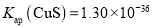
 ,经过计算可得该反应的平衡常数
,经过计算可得该反应的平衡常数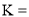 ______。
______。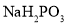 的
的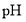 ______7(填“>”、“=”或“<”)。
______7(填“>”、“=”或“<”)。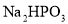 溶液呈碱性的原因为(用离子方程式表示)______。
溶液呈碱性的原因为(用离子方程式表示)______。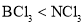 B.
B.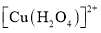 比
比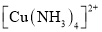 中的配位键稳定
中的配位键稳定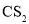 中的溶解度:
中的溶解度: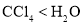 D.基态原子中未成对电子数:
D.基态原子中未成对电子数: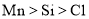
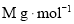 ,金属原子半径为
,金属原子半径为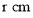 ,用
,用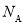 表示阿伏加德罗常数的值),有关说法正确的是______(填字母序号)。
表示阿伏加德罗常数的值),有关说法正确的是______(填字母序号)。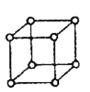 ②
②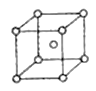 ③
③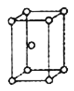 ④
④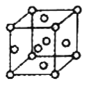
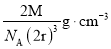 D.④中空间利用率为:
D.④中空间利用率为: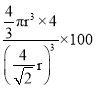 %
%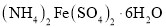 。“摩尔盐”在一定条件下分解的方程式为:
。“摩尔盐”在一定条件下分解的方程式为: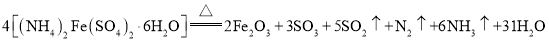 。
。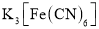 常用于检验
常用于检验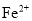 ,与
,与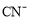 互为等电子体的单质的分子式为______。
互为等电子体的单质的分子式为______。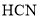 分子中
分子中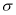 键和
键和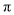 键的个数之比为______。
键的个数之比为______。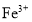 可与噻吩(
可与噻吩(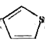 )和吡咯(
)和吡咯(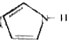 )形成配位化合物。噻吩中
)形成配位化合物。噻吩中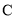 原子和
原子和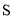 原子的杂化分式分别为:______。噻吩难溶于水,吡咯能溶于水,原因为:______。
原子的杂化分式分别为:______。噻吩难溶于水,吡咯能溶于水,原因为:______。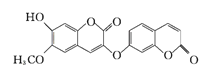
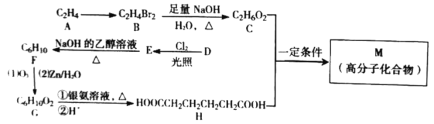
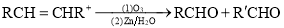 (R、
(R、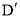 代表烃基或氢原子)。
代表烃基或氢原子)。