-
已知NaOH+Al(OH)3=Na[Al(OH)4]。向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是( )
A.CO2+2OH−=CO32−+H2O B.Al2O3+2OH−+3 H2O=2 [Al(OH)4] −
C.2 Al+2OH−+6H2O=2 [Al(OH)4] −+3 H2↑ D.Al3++4 OH−=[Al(OH)4]−
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
难度: 简单查看答案及解析
-
下列有关氧化还原反应的叙述中,正确的是
A. 一定有氧元素参加 B. 氧化反应一定先于还原反应发生
C. 氧化剂本身发生氧化反应 D. 一定有电子转移(得失或偏向)
难度: 简单查看答案及解析
-
下列现象或事实、解释都正确的是( )
选项
现象或事实
解释
A
金属镁着火不能用泡沫灭火器灭火
燃烧生成的MgO与CO2反应
B
K2FeO4用于自来水的消毒和净化
K2FeO4具有强氧化性可杀菌消毒,其还原产物Fe3+水解得到的胶状物能净水
C
古代青铜器表面有铜锈,可放入盐酸中浸泡除锈
铜锈是铜在空气中缓慢氧化生成的氧化物,可溶于盐酸
D
常温下,将铁片浸入足量的浓硫酸中,铁片不溶解
常温下,铁与浓硫酸一定没有发生化学反应
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
分子式为 C4H10O并能与金属钠反应放出氢气的有机化合物有( )
A.3种 B.4种 C.5种 D.6 种
难度: 简单查看答案及解析
-
下列说法错误的是 ( )
A.乙烷室温下能与浓盐酸发生取代反应
B.乙烯可以用作生产食品包装材料的原料
C.乙醇室温下在水中的溶解度大于溴乙烷
D.乙酸与甲酸甲酯互为同分异构体
难度: 中等查看答案及解析
-
下列由实验得出的结论正确的是
选项
实验
结论
A
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2二溴乙烷无色、可溶于四氯化碳
B
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的氯甲烷具有酸性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是
A. 计算机芯片的材料是经提纯的二氧化硅
B. “地沟油”可以用来制肥皂和生物柴油
C. 硅胶、生石灰、铁粉是食品包装中常用的干燥剂
D. 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1mol羟基(
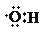 )中含有的电子数为0.7NA
)中含有的电子数为0.7NAB.1L 0.1mol•L-1的AlCl3溶液中含有Al3+的数目为0.1NA
C.0.1mol N2与0.3molH2反应,转移的电子数为0.6NA
D.标准状况下,1.12L HCHO中C原子的数目为0.05NA
难度: 中等查看答案及解析
-
已知O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是
A.氧气是氧化产物 B.O2F2是还原剂
C.若生成3.2gO2,则转移0.4mole- D.还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A.MgO、Al2O3熔点高,均可用作耐高温材料 B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂 D.SO2具有氧化性,可用于漂白纸浆
难度: 简单查看答案及解析
-
某期刊封面上一个分子球棍模型图如图所示,图中“棍”代表单键、双键或三键,不同颜色的球代表不同元素的原子。该模型图可代表一种
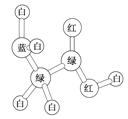
A.醇 B.酸 C.酯 D.氨基酸
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在0.01 mol•L-1Ba(OH)2溶液中:Al3+、NH
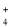 、NO
、NO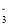 、HCO
、HCO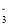
B.0.1 mol•L-1的FeCl2溶液中:H+、Al3+、SO
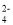 、ClO-
、ClO-C.滴加KSCN溶液显红色的溶液:NH
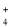 、K+、Cl-、I-
、K+、Cl-、I-D.由水电离产生的c(H+)=1×10-13mol•L-1的溶液中:Na+、Ba2+、NO
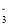 、Cl-
、Cl-难度: 中等查看答案及解析
-
下列离子方程式的书写及评价均合理的是
离子方程式的书写
评价
A
向Mg(HCO3)2溶液中加入足量的NaOH溶液:Mg2++2 HCO3—+2OH-= MgCO3↓+CO32—+ 2H2O
正确,NaOH过量,酸式盐与碱完全反应生成正盐和水
B
1 mol/L的NaAlO2溶液与2.5 mol/L的HCl溶液等体积混合:2AlO2—+5H+= Al3++Al(OH)3↓+H2O
正确,AlO2—与H+按物质的量之比1∶1反应转化为Al(OH)3,过量的H+再将一部分Al(OH)3转化为Al3+
C
将少量的Fe3O4溶解在过量的稀HNO3中:Fe3O4+8H+= Fe2+ + 2Fe3+ + 4H2O
正确,Fe3O4的化学式可改写为FeO·Fe2O3,Fe2+与Fe3+的物质的量之比为 1∶2
D
将少量NaClO溶液滴入FeSO4溶液中:2Fe2+ +ClO-+5H2O= 2Fe(OH)3↓+ Cl-+4H+
正确,Fe2+ 与ClO-会发生氧化还原反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4,并利用下列装置从含NaIO3的废液中制取单质碘的CCl4溶液并回收NaHSO4。
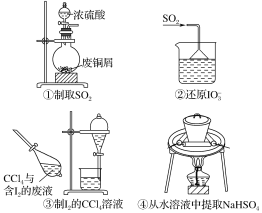
其中装置正确且能达到实验目的的组合是( )
A.①②③④ B.①②③
C.②④ D.②③
难度: 中等查看答案及解析
-
实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是
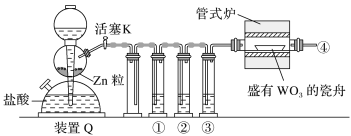
A.①②③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
难度: 中等查看答案及解析
-
铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
A.9.02 g B.8.51 g C.8.26 g D.7.04 g
难度: 中等查看答案及解析
-
向200 mL 2 mol·L-1HNO3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)变化如图所示。下列有关说法正确的是( )
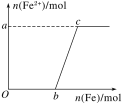
A.该过程中产生标准状况下的氢气4.48 L
B.向c点处的反应液中加入稀盐酸后无明显现象
C.图中a=1.5、b=1.5
D.当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n) mol
难度: 困难查看答案及解析
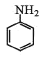 )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
)是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。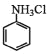
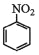 +3Sn+12HCl→2
+3Sn+12HCl→2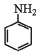 +3SnCl4+4H2O
+3SnCl4+4H2O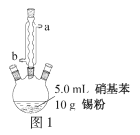
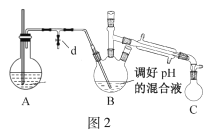
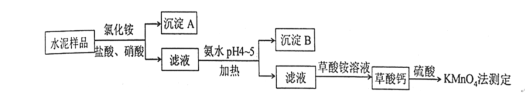
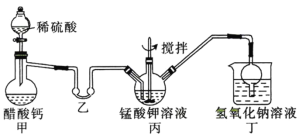
 B.
B. 
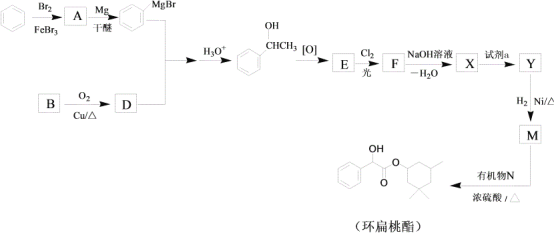
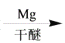 R-MgX
R-MgX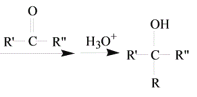 (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)