-
NA是阿伏加德罗常数的值,下列说法正确的是
A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B.22.4 L(标准状况)氩气含有的质子数为18 NA
C.92.0 g甘油(丙三醇)中含有羟基数为1.0 NA
D.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0 NA
难度: 简单查看答案及解析
-
下列说法正确的是
A.BF3和NCl3中,每个原子的最外层都具有8电子稳定结构
B.金刚石和石英晶体的熔点差别大的主要原因是共价键键长不同
C.NaOH熔化的过程中,既破坏了离子键又破坏了共价键
D.常温常压下,H2O是液态,H2S是气态,说明H2O的热稳定性更好
难度: 中等查看答案及解析
-
以下是人们面对“新型冠状病毒肺炎”防护的一些认识,你认为正确的是
A.日常使用84消毒液时,可添加大量洁厕净以增强杀菌效果
B.医用消毒酒精其纯度为75%指的是体积分数
C.N95型口罩是指能完全过滤直径小于9.5μm 胶粒的防护口罩
D.可向人体注射消毒液来有效杀灭体内新冠病毒
难度: 简单查看答案及解析
-
“摩尔庄园”是一款专门为7﹣12岁儿童设计的安全健康益智网页游戏,它和我们高中化学的“摩尔”没有任何的关系,我们所学的“摩尔”其实是
A.国际单位制中的一个物理量
B.摩尔是表示物质的量
C.摩尔是物质的量的单位
D.摩尔是表示物质数量的单位
难度: 简单查看答案及解析
-
下列物质的名称不正确的是( )
A.KAl(SO4)2·12H2O:明矾 B.H4SiO4:原硅酸
C.
 :新戊烷 D.
:新戊烷 D.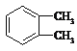 :二甲苯
:二甲苯难度: 简单查看答案及解析
-
下列关于海水资源综合利用的说法不正确的是
A.蒸馏法是海水淡化的方法之一
B.海水晒盐是化学变化
C.从海水中可制取钠、镁、溴等化工产品
D.从海水获得物质和能量具有广阔的前景
难度: 简单查看答案及解析
-
欲除去下列物质中混入的少量杂质(括号内物质为杂质),能达到目的的是( )
A.乙醇(乙酸):加入新制生石灰,蒸馏
B.苯(溴):加入氢氧化钠溶液,过滤
C.乙醇(水):加入金属钠,充分振荡静置后,分液
D.乙烷(乙烯):通入酸性高锰酸钾溶液,洗气
难度: 中等查看答案及解析
-
大米、蔬菜、食盐、蔗糖、食醋、纯碱、洁厕灵等都是居民日常生活中经常使用的物质,下列有关说法或表示正确的是)
A.蔗糖与醋酸都是弱电解质
B.大米的淀粉和蔬菜中的纤维素的化学式均为(C6H10O5)n,两者互为同分异构体
C.纯碱属碱,其阳离子与食盐中阳离子相同,其离子结构示意图为:
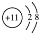
D.洁厕灵中有效成分HCl,其电子式为:
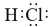
难度: 中等查看答案及解析
-
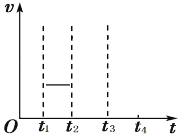
如图为某反应分别在有和没有催化剂条件下的能量变化示意图,下列说法不正确的是

A.反应过程 b 有催化剂参与
B.该反应为放热反应,热效应等于 ΔH
C.有催化剂条件下,反应的活化能等于 E1+E2
D.反应过程 a 需要外界供给能量才能持续进行
难度: 中等查看答案及解析
-
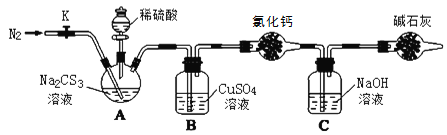
实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:

下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.醋酸钠溶液呈碱性,往0.1mol·L-1醋酸溶液加入少量醋酸钠固体后,可促进醋酸电离
B.T℃时,pH为6.8的溶液,该溶液一定呈酸性
C.相同温度下,pH相等的氨水、NaOH溶液中,n(NH4+)与n(Na+)相等
D.pH相等的盐酸和醋酸溶液等体积混合(忽略温度和体积变化),混合溶液中c(Cl-) = c(CH3COO-)
难度: 中等查看答案及解析
-
一种直接铁燃料电池(电池反应为3Fe+2O2=Fe3O4)的装置如图所示,下列说法正确的是( )
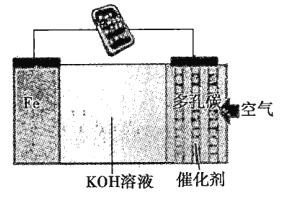
A.Fe极为电池正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线移向Fe极
D.5.6gFe参与反应,导线中转移1.204×1023个电子
难度: 中等查看答案及解析
-
下表中根据实验操作和现象所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
淀粉溶液中加入稀硫酸,充分加热,冷却后,加入银氨溶液,水浴加热
无银镜生成
淀粉未水解
B
浸透石蜡的油矿渣棉,加入催化剂,强热,产生的气体通入溴水
溴水褪色
气体中只有乙烯
C
在0.6mol金属钠中加入过量的液态有机物C2H6O,收集产生的气体
气体为6.72L(标准状况)
有机物为CH3OCH3
D
含5g油脂的酒精溶液中加入适量40%NaOH溶液加热5min,然后用玻璃棒蘸取少许滴到盛热水的试管中
液面无油滴出现
油脂已完全皂化
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
四种短周期元素的相关信息如下表所示:
元素
相关信息
X
它存在多种同素异形体,可用于制作钻头、电极和纳米材料
Y
最外层电子数是内层电子数的3 倍
Z
第三周期中最高价氧化物的水化物碱性最强
W
与X 元素处于同一主族,工业上常用X 的单质还原W的氧化物制取W单质
下列说法正确的是
A.原子半径: W>Z>Y>X B.最高价氧化物对应水化物的酸性: X>W
C.最低价气态氢化物的热稳定性: W>X D.Y、Z 两种元素只能形成化合物Z2Y
难度: 中等查看答案及解析
-
我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如图。
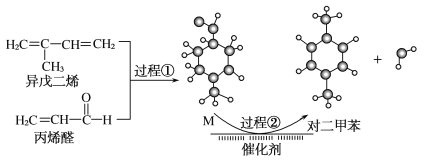
下列说法正确的是( )
A.过程①发生了取代反应
B.中间产物M的结构简式为

C.利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯
D.该合成路线原子利用率为100%,最终得到的产物易分离
难度: 困难查看答案及解析
-
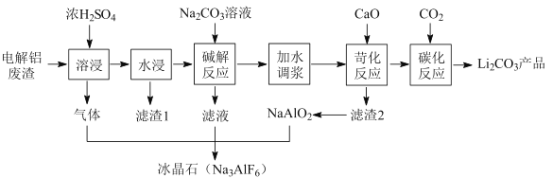
从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)
 PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4难度: 困难查看答案及解析
-
CO2与H2在一定条件下发生反应生成燃料甲[CH3OH(g)]:CO2(g)+2H2(g)
 2CH3OH(g)。某研究小组将2molCO2和4molH2置于一体积不变的密闭容器中,测定不同时间段内H2的转化率,得到如下表数据:
2CH3OH(g)。某研究小组将2molCO2和4molH2置于一体积不变的密闭容器中,测定不同时间段内H2的转化率,得到如下表数据:t(小时)
2
4.5
5
6
H2转化率
30%
40%
70%
70%
根据以上信息作出的下列判断中正确的是
A.4.5小时混合气体的密度和相对分子质量比2小时混合气体的都大
B.反应在5.5小时时,v正(H2)=v(逆)(CH3OH)
C.6小时容器中剩余1.3molCO2
D.若其它条件不变将CO2的物质的量改为10mol则可得128g甲醇
难度: 中等查看答案及解析
-
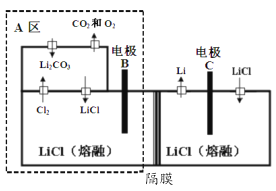
我国化学家侯德榜发明的“侯氏制碱法”联合合成氨工业生产纯碱和氮肥,工艺流程图如下。碳酸化塔中的反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
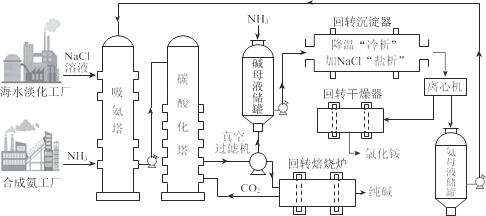
下列说法不正确的是
A.以海水为原料,经分离、提纯和浓缩后得到饱和氯化钠溶液进入吸氨塔
B.碱母液储罐“吸氨”后的溶质是NH4Cl和NaHCO3
C.经“冷析”和“盐析”后的体系中存在平衡 NH4Cl(s)
 NH4+(aq) + Cl-(aq)
NH4+(aq) + Cl-(aq)D.该工艺的碳原子利用率理论上为 100%
难度: 困难查看答案及解析
-
在容积不变的容器中加入一定量的A和B,发生反应∶2A(g)+B(g)
 2C(g), 在相同时间内,测得不同温度下A的转化率如下表所示,下列说法正确的是
2C(g), 在相同时间内,测得不同温度下A的转化率如下表所示,下列说法正确的是温度/°C
100
200
300
400
500
转化率
30%
75%
75%
50%
18%
A.该反应随着温度升高,反应速率先变大后变小
B.200°C,A的转化率为75%时,反应达到平衡状态
C.当单位时间内生成n mol B的同时消耗2n molC时,反应达到平衡状态
D.400°C时,B的平衡浓度为0.5 mol/L,则该反应的平衡常数K=2
难度: 中等查看答案及解析
-
某溶液中含K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-中的若干种,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰。
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成。
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色。下列说法正确的是
A.原溶液中肯定不含Fe2+、NO3-、SiO32-、I-
B.原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42-
C.步骤Ⅱ中无色气体是NO气体,无CO2气体产生
D.为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
难度: 困难查看答案及解析